Использование реакций комплексообразования в аналитической химии
Реакции комплексообразования широко используются в аналитической химии с различными целями:
1) для обнаружения [3];
2) для разделения и маскирования [3];
3) для определения. На использовании реакций комплексообразования основаны следующие методы количественного химического анализа:
§ гравиметрический метод осаждения (если комплексное соединение является малорастворимым) [4];
§ комплексометрическое титрование [4];
§ косвенные методы определения в кислотно-оснóвном и окислительно-восстановительном титровании [4];
4) для растворения твердых проб [3];
5) для изменения кислотно-оснóвных свойств системы. Например, слабую борную кислоту H3BO3 (pK1 = 9,15; pK2 = 12,74; pK3 = 13,80) невозможно определить методом кислотно-оснóвного титрования, поскольку при таких значениях pKа скачок на кривой титрования отсутствует. Однако H3BO3 может образовывать более сильные комплексные кислоты с рядом многоатомных спиртов (этиленгликоль, глицерин, маннит и др.). Поэтому до титрования в раствор вводят многоатомный спирт. При этом протекает реакция (на примере этиленгликоля):

 СН2 – ОН НО ОН НО – СН2
СН2 – ОН НО ОН НО – СН2
 | + В + | →
| + В + | →
СН2 – ОН ОН НО – СН2


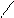 СН2 – О О – СН2 –
СН2 – О О – СН2 –


 → | В | Н+ + 3Н2О
→ | В | Н+ + 3Н2О
СН2 – О О – СН2
Образовавшаяся комплексная кислота Н[В(С2Н4О2)2] имеет рKа = 4,48, поэтому при титровании ее раствором щелочи:
Н[В(С2Н4О2)2] + NaOH = Na[В(С2Н4О2)2] + H2O
получается явно выраженный скачок на кривой титрования. Во многих методиках определения борной кислоты используют маннит – шестиатомный спирт, изомер сорбита;
6) для изменения окислительно-восстановительных свойств системы. Как показано в разделе 4, связывание в комплекс окисленной или восстановленной форм всегда вызывает изменение потенциала.
Константа устойчивости Kуст. – основная характеристика комплексного соединения, численное значение которой необходимо для решения многих химико-аналитических задач:
1) расчет равновесных концентраций ионов в растворах комплексных соединений (см. пример 20);
2) расчет сложных равновесий в многокомпонентных растворах:
- расчет растворимости малорастворимого электролита, если один из ионов одновременно участвует в реакции комплексообразования;
- расчет окислительно-восстановительного потенциала, если один из компонентов сопряженной окислительно-восстановительной пары одновременно участвует в реакции комплексообразования (см. пример 19);
3) расчет кривых комплексометрического титрования;
4) выбор маскирующего агента для конкретного иона [2, с. 65, пример 11];
5) оценка возможности обнаружения или количественного определения конкретного иона с использованием реакций комплексообразования [2, с. 65, пример 12];
6) прогнозирование возможности титрования ионов-комплексообра-зователей или ионов-лигандов [2, с. 65, пример 12];
7) расчет индикаторных ошибок комплексонометрического титрования (по значениям Kуст. комплексонатов металлов).
