Ионное произведение воды. Водородный показатель
До сих пор мы предполагали и рассматривали процесс диссоциации рас-
творенного вещества под действием молекул растворителя. Но возможен про-
цесс и самодиссоциации растворителя. То есть взаимодействие между собст-
венными молекулами растворителя настолько значительно, что может привести
к разрыву связей внутри молекул с образованием новых заряженных частиц –
ионов. Например, вода диссоциирует на ионы водорода и гидроксила
Н2Ожид. ↔ Н+раствор + ОН-раствор,
и как следствие – чистая вода обладает электропроводностью (правда, незначи-
тельной). Следует отметить, что в воде протон сольватирован и существует в виде иона гидроксония (гидрония) Н3О+. С учетом этого уравнение процесса диссоциации воды (автопротолиз воды) можно записать:
2Н2О ↔ Н3О+ + ОН-
На практике, однако, чаще используют форму записи Н+, чем Н3О+
В условиях равновесия процесс самодиссоциации воды можно оха-
рактеризовать константой диссоциации Кн2о
[ H + ] · [OH − ]
Кд (н2о) = ———————.
[ H 2 O]
Ее величина очень мала и при 22 оС составляет значение равное 1,8 ·10-16.
Из этого следует, что в воде образуется очень незначительное количество ионов
водорода Н+ и гидроксила ОН- (числитель выражения), а следовательно, и рас-
падается незначительная часть молекул воды. Поэтому можно без большой
ошибки считать равновесную концентрацию нераспавшихся молекул воды
[H2O] в приведенном выражении равной концентрации исходной воды (до дис-
социации), которая для одного литра воды, принимая во внимание плотность
воды и ее молярную массу, равна:
1000 г
[H2O] = ——————— = 55,56 моль/л
18 (г / моль) · 1л
где 1000 г – масса одного литра воды, 18 – молярная масса воды. Если подста-
вить величину концентрации воды в выражение константы диссоциации, то по-
лучим:
[ H+][OH−]
1,8·10-16 = ————— или [H+][OH-] = Кводы · 55,56 = 1,8 · 10-16 · 55,56 =
55,56
1·10-14.
Последнее выражение ─ произведение молярных концентраций ионов водорода и гидроксила ─ называют ионным произведением воды. Величина эта постоянная при
данной температуре и характеризует соотношение концентраций ионов водо-
рода и гидроксила чистой воды. Из ионного произведения воды видно, что кон-
центрации ионов водорода и гидроксила равны между собой и в чистой воде
составляют величину, равную
[H+] = [OH-] = 1·10-7 моль/л.
Это и понятно, так как каждая распавшаяся молекула воды поставляет одно-
временно один ион водорода Н+ и один ион гидроксила ОН-.
Если вспомнить, что ион водорода Н+ является носителем кислотных
свойств, а ион гидроксила ОН- ─ основных, то при равенстве их концентраций
[H+] = [OH-] = 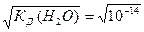 =10-7 моль/л вода является нейтральным электролитом: ни кислым, ни основным. Вода выступает в роли амфолита. Если же концентрация ионов водорода [H+] в водном растворе будет в силу каких-то причин больше концентрации ионов гидроксила [OH-] (например, при добавлении молекул кислоты, распадающихся на ионы водорода и кислотного остатка), то раствор будет кислым. Если же, наоборот, концентрация ионов гидроксила будет больше, чем
=10-7 моль/л вода является нейтральным электролитом: ни кислым, ни основным. Вода выступает в роли амфолита. Если же концентрация ионов водорода [H+] в водном растворе будет в силу каких-то причин больше концентрации ионов гидроксила [OH-] (например, при добавлении молекул кислоты, распадающихся на ионы водорода и кислотного остатка), то раствор будет кислым. Если же, наоборот, концентрация ионов гидроксила будет больше, чем
ионов водорода, то раствор окажется основным.
Например, если в растворе концентрация ионов водорода [H+] = 10-4
моль/л, а концентрация ионов гидроксила соответственно равна [OH-] =10-10
моль/л (их произведение должно равняться [H+][OH-]= 10-14), то концентрация
ионов водорода больше концентрации ионов гидроксила [H+] > [OH-], и раствор
окажется кислым (говорят: среда кислая).
Для характеристики кислотности среды можно установить различные
шкалы, используя соотношение между концентрациями ионов водорода и гид-
роксила, как это представлено на рис. 2.2.
а [H+], моль/л 10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8 10-9 10-10 10-11 10-12 10-13 10-14
кислая среда нейтральная среда щелочная среда
б рН=- lg[ H +] 1 2 3 4 5 6 7 8 9 10 11 12 13 14
Рис. 2.2. Шкалы кислотности с использованием: а – концентрации
ионов водорода, моль/л; б – водородного показателя рН
Использовать шкалу «а» (Рис.2.2) не совсем удобно, приходится все время
выражать концентрацию ионов водорода в моль/л, применяя отрицательную
степень. В практической работе принято выражать концентрацию ионов водо-
рода через так называемый водородный показатель рН, который представляет
собой просто один только показатель степени концентрации ионов водорода
без отрицательного знака. С математической точки зрения рН ─ это отрица-
тельный десятичный логарифм молярной концентрации ионов водорода:
рН = - lg[H+].
Если, например, [H+] = 10-4 моль/л, то рН = - lg[10-4]= 4 (среда кислая). При рав-
ных концентрациях ионов водорода и гидроксила [H+] = [OH-] = 10-7моль/л рас-
твор будет нейтральным и его рН = - lg [10-7] = 7 (среда нейтральная). Если рН <
7, то среда кислая; если рН > 7, то среда щелочная.
Иногда применяют не показатель рН, а показатель ионов гидроксила рОН
(по аналогии с рН), равный
рОН = -lg[OH-].
Сумма показателей ионов водорода и гидроксила для данного раствора должна
быть равной 14, т.е. рН + рОН = 14, так как логарифмирование ионного произ-
ведения воды дает следующее соотношение lg ([H+]·[OH-]) = lg 10-14 , или lg[H+] + lg[OH-] = -14, а отсюда, принимая во внимание, что рН = -lg[H+] и pOH = - lg[OH-], получим:
рН + рОН = 14.
Следует отметить, что при расчете рН и рОН концентрациями [H+] и [OH-] можно пользоваться лишь в растворах, ионная сила которых близка к нулю, коэффициенты активности единице, а значит активности равны концентрациям. В противном случае ионное произведение воды равно произведению активностей протонов и гидроксид-ионов:
Кводы = а (Н+) ∙ а (ОН-).
Так, для растворов с высокой концентрацией электролитов водородный показатель обозначается раН и равен отрицательному логарифму активной (эффективной) концентрации (активности) ионов водорода:
: раН = -lg([H+] · fH+ ) = -lg[H+] - lg fH+ = pH - lg fH+ , раОН = -lg([ОH-] · fHО- ) = -lg[ОH-] - lg fОH- = pОH - lg fОH-, где fH+― коэффициент активности протонов в данном растворе.
Рассмотрим несколько примеров расчета рН растворов.
Пример 1. Каково будет значение рН 0,001 нормального раствора КОН, ес-
ли допустить, что степень диссоциации щелочи в растворе 100%?
Решение. Гидроксид калия в водном растворе диссоциирует на ионы калия
и гидроксила:
КОН → К+ + ОН-.
Поскольку диссоциация растворенного гидроксида калия полная, то концен-
трация гидроксил ионов ОН- равна 0,001 моль/л (так же как и ионов калия). Учи-
тывая, что концентрации ионов водорода и гидроксила связаны между собой
ионным произведением, равным [H+]·[OH-] = 10-14, найдем концентрацию ионов
водорода в этом растворе:
[H+] = 10-14 / [OH-] = 10-14 / 0,001 = 10-11 моль/л.
Зная концентрацию ионов водорода, рассчитаем рН раствора: рН = -lg10-11 = 11.
Пример 2. Какова концентрация ионов гидроксила в растворе, рН которого
равен 5?
Решение. По величине рН определяем концентрацию ионов водорода Н+ в
растворе: так как рН = -lg [H+], то lg[H+] = -5 и [H+] = 10-5 моль/л. Концентра-
цию ионов ОН- рассчитываем исходя из ионного произведения воды:
[OH-] = 10-14 / 10-5 = 10-9 моль/л.
Пример 3.Молярные концентрации четырех двухкомпонентных растворов, содержащих фруктозу, H2SO4, HCl, CH3CO2H одинаковы и составляют 0,001М. Осмотическое давление, создаваемое каким раствором будет наибольшее и наименьшее?
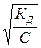 Решение. Очевидно, что концентрация частиц наименьшая в растворе фруктозы, потому что это органическое соединение, которое почти не диссоциирует в водных растворах. Уксусная кислота – слабый электролит и диссоциирует неполностью. Степень диссоциации
Решение. Очевидно, что концентрация частиц наименьшая в растворе фруктозы, потому что это органическое соединение, которое почти не диссоциирует в водных растворах. Уксусная кислота – слабый электролит и диссоциирует неполностью. Степень диссоциации
α= =
Серная и соляная кислоты – сильные электролиты и диссоциируют полностью на ионы, но HCl распадается на две частицы, а H2SO4 – на три.
Получаем следующие значения концентрации частиц в растворах:
Фруктоза – 0,0010 М
CH3CO2H – 0,0011 М
HCl - 0,0020 М
H2SO4 – 0,0030 М
