Химические и физико-химические методы устранения жесткости воды
Жесткая вода обладает рядом качеств, которые делают ее менее превликательной в производственных процессах. В жесткой воде мыла и стиральные порошки плохо пенятся, что приводит к перерасходу а процессах стирки и мойки оборудовании и деталей. В паровых котлах и компрессорах во время их эксплуатации образуется накипь- отложение мраморного слоя на стенках металла, что часто приводит к аварии или взрывам.
Умягчение воды проводится с целью предотвращения образования в паровых котлах и теплообменных аппаратах накипи и для экономии стиральных средств в процессах стирки и мойки.
Жесткость воды чаще всего устраняется при помощи ионитов и известково-содовым методом. Другие методы находят более ограниченное применение в виду их нерентабельности (высокая стоимость и трудоемкость).
Умягчение воды может быть достигнуто: 1) осаждением иона кальция (обычно совместно с ионом магния) и последующим удалением осадка; 2) удалением иона кальция (и магния) методом ионного обмена.
Метод ионного обмена основан на способности ионитов поглощать из растворов одни ионы и отдавать взамен другие. Иониты, способные обменивать находящиеся в растворе катионы, называются катионитами. К катионитам относятся: алюмосиликаты, сульфированные угли, синтетические смолы. Характерной особенностью катионитов является наличие в них большого числа кислотных групп: силикатных, карбоксильных и сульфогрупп. Эти кислотные группы содержат ионы водорода, которые подвижны и могут быть заменены на различные катионы (R-SO2OH + Me+ R-SO2OMe + H+).
Иониты, обменивающие анионы с находившимися в растворе ионами солей и кислот, называются анионитами. Аниониты представляют собой аминосмолы, содержащие амино (-NH2) и имино (-NH) группы. Способность этих групп образовывать соли с различными анионами и используется для анионного обмена R-NH2 + HOH [R-NH3]+OH-
[R-NH3]+OH- + А- [R-NH3]+ A- + OH-
Для умягчения воды применяются обычно катиониты в водородной (Н-катиониты) и натриевой (Na-катиониты) форме. Если обозначить весь катионит, кроме подвижного иона (например, натрия), буквой R, то реакции ионного обмена в жесткой воде (содержащей ионы кальция и магния) могут быть выражены следующими уравнениями:
Na2R + (Са,Mg) (НСО3)2 (Са, Mg)R + 2NаНСО3
Na2R + (Са,Mg) SO4 (Са, Mg)R + Na2SO4
Na2R + (Са, Mg)Cl2 (Са, Mg)R + 2NaCl
Количество катионов кальция и магния, которое может быть поглощено определенным количеством катионита, называется емкостью поглощения Е и выражается в моль эквивалентах на 1 м3 ионита. Например, емкость поглощения сульфоугля равна 1000 моль экв/м3; эспатита -1700 моль экв/м3; алюмосиликатов - 850 моль экв/м3.
После длительной работы иониты насыщаются и теряют свои эксплуатационные качества. С целью возобновления работы ионита их подвергают процессу регенерации.
Для регенерации катионитов натрия на кальций, ионит регенерируют, т. е. пропускают через него насыщенный раствор хлорида натрия. При этом ионы кальция вытесняются ионами натрия.
Другой распространенный способ умягчения воды - известково-содовый. Для очистки воды по известково-содовому методу используют смесь соды и гашеной извести. При действии извести соли, дающие карбонатную жесткость, и растворенный в воде оксид углерода (IV) переводятся в осадок:
Са(НСО3)2 + Са(ОН)2 2СаСО3 + 2Н20
Mg(НСО3)2 + Са(ОН)2 MgCO3 + СаСО3 + 2Н20
СО2 + Са(ОН)2 СаСО3 + Н2О
Одновременно магниевая жесткость заменяется на кальциевую, так как образовавшийся в качестве продукта ионного обмена гидроксид магния в воде растворим хуже, чем гидроксид кальция:
MgCl2 + Са(ОН)2 Mg(OH)2 + CaСl2
Содой удаляют соли, обусловливающие наличие некарбонатной жесткости:
CaSO4 + Nа2СО3 СаСО3 + Na2SO4
CaCI2 + Na2CO3 СаСО3 + 2NaCl
Карбонаты выпадают в виде взвеси. После фильтрования вода содержит соли, не дающие накипи, поэтому вполне пригодна для многих промышленных целей.
В последние годы все большее значение приобретает метод удаления солей с помощью постоянного электрического тока, называемый электродиализом. Этот метод оказался более экономичным по сравнению с ионообменным.
Принцип метода заключается в следующем (рис.1). Если через воду, находящуюся в ванне, разделенной полупроницаемыми диафрагмами на три отделения, пропускать постоянный электрический ток, то при соответствующем напряжении будет происходить электролиз растворенных солей. Катионы из анодного пространства и из средней камеры под действием электрического поля перемещаются в катодное пространство, где накапливается раствор гидроксидов натрия, калия, магния и др.
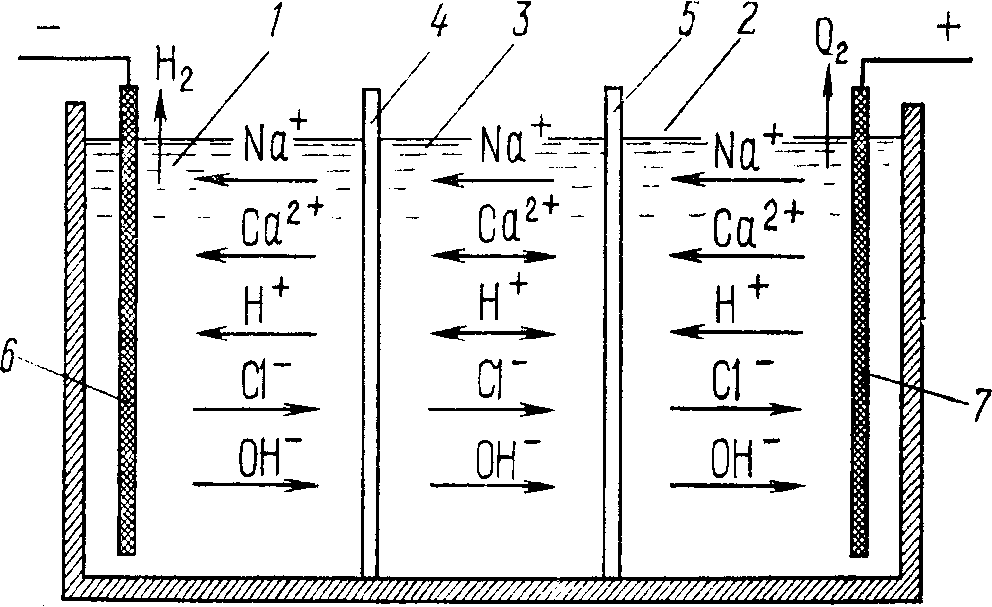
Рис. 1. Схема обессоливания воды электродиализом: 1,2 - катодное и анодное пространства; 3- межэлектродное пространство (обессоливаемая вода); 4, 5- катодная и анодная мембраны; 6,7- катод и анод.
Анионы, в свою очередь, из катодного пространства и из средней камеры перемещаются в анодное пространство, где накапливаются кислоты-соляная и серная. На катоде происходит разрядка ионов водорода и выделение водорода. На аноде выделяется кислород и частично хлор за счет разрядки молекул воды, а частично гидроксид-ионов, а также хлорид-ионов. По мере прохождения электролиза в средней камере количество катионов и анионов кислот уменьшается и получается обессоленная вода. Загрязненную солями воду из катодного и анодного пространства выливают, поскольку она является отходом, а из среднего пространства частично очищ6енная вода поступает в другой электродиализатор.
Описанный метод применяется для опреснения воды, например морской, используемой для бытовых нужд, так и для получения воды особой чистоты, используемой при получения ультрачистых веществ.
Цель работы: Умягчить водопроводную воду катионитовым или известково-содовым методом: определить жесткость воды до и после умягчения. Ознакомиться с методом приготовления катионита, приготовить катионит.
