Процентная концентрация раствора по массе
Процентная концентрация раствора показывает, сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора.
Например, 12%-й раствор КОН должен содержать 12 ед. массы КОН в 100 ед. массы раствора и для его приготовления следует взять 12 ед. массы КОН и 88 ед. массы растворителя. Процентную концентрацию (%масс.) можно рассчитать, пользуясь соотношением:
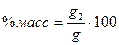 , (3.6)
, (3.6)
где g – масса раствора, г; g2 – масса растворенного вещества, г.
Часто концентрацию раствора характеризуют величиной его плотности, т. к. определенной плотности раствора при данной температуре соответствует определенное содержание вещества в растворе. Масса раствора g связана с его объемом V и плотностью 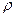 соотношением
соотношением 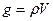 ,откуда выражение (1.6) принимает вид
,откуда выражение (1.6) принимает вид
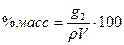 (3.7)
(3.7)
Пример. Определить процентную концентрацию раствора хлорида калия КС1, содержащего 53г КС1 в 0.5 л раствора. Плотность раствора 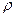 = 1.063 г×см--3.
= 1.063 г×см--3.
Решение.Масса 0.5 л (500см3) раствора составляет 500×1.063=531.5 г.
53г КС1 содержится в 531.5 г раствора
х г КС1 содержится в 100 г раствора, откуда
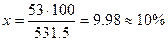 ,
,
т. е. процентная концентрация раствора КС1, содержащего 53 г в 0.5 л раствора, составляет 10% масс.
Моляльная концентрация раствора
Моляльная концентрация (или моляльность) выражается числом молей растворенного вещества, содержащимся в 1 кг (1000 г) растворителя. Моляльные концентрации не зависят от температуры и применяются главным образом при точных физико-химических измерениях. Единицей измерения моляльной концентрации m является [m] = 1 моль/кг растворителя.
Формула для расчета моляльной концентрации имеет вид
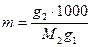 , (3.8)
, (3.8)
где 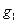 – масса растворителя, г;
– масса растворителя, г; 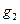 – масса растворенного вещества, г;
– масса растворенного вещества, г; 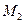 – молярная масса растворенного вещества г×моль-1.
– молярная масса растворенного вещества г×моль-1.
Пример. Рассчитать моляльную концентрацию раствора, полученного при растворении 43.83г хлорида натрия NaCl в 500г воды.
Решение. На 1000г воды приходится 43.83×2=87.66г NaCl. Молярная масса NaCl 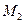 =58.44 г×моль-1, следовательно, 87.66г этой соли составит
=58.44 г×моль-1, следовательно, 87.66г этой соли составит
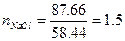 моль.
моль.
Таким образом, моляльность раствора хлорида натрия 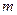 =1.5 моль/кг Н2О.
=1.5 моль/кг Н2О.
3.2.2 Объемные концентрации растворов
Молярная концентрация
Молярная концентрация (или молярность) показывает число молей растворенного вещества, содержащихся в 1 л раствора.
Одномолярным называется раствор, в 1 л которого содержится 1 моль растворенного вещества (1М). Растворы, содержащее в 1 л доли молей, например, 0,1; 0,2; 0,01; 0,001 и т. д. называются соответственно, децимолярными (0,1М), двудецимолярными (0,2М), сантимолярными (0,01М), миллимолярными (0,001М) и т. д. Растворы, содержащие 2, 3, 4 и более моля растворенного вещества в 1 л раствора, называются, соответственно, двумолярными (2М), трехмолярными (3М), четырехмолярными (4М) и т. д.
Молярную концентрацию (в моль/л) растворенного вещества можно рассчитать по формуле
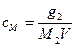 , (3.8)
, (3.8)
где 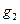 – масса растворенного вещества, г; М2 – молярная масса растворенного вещества г×моль-1; V – объем раствора, л (дм3).
– масса растворенного вещества, г; М2 – молярная масса растворенного вещества г×моль-1; V – объем раствора, л (дм3).
Пример. Какова масса гидроксида натрия NaОН, содержащегося в 200см3 раствора, если молярная концентрация раствора равна 0,2 моль/л.
Решение. Молярная масса NaОН составляет: М2= 23+16+1=40 г×моль-1.
В 1000 см3 0,2 М раствора содержится 0,2 моль NaOH
В 200 см3 0,2 М раствора — х моль NаОН, отсюда
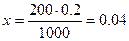 моль NaOH в 200 см3 раствора.
моль NaOH в 200 см3 раствора.
Тогда, масса NaОН, содержащаяся в 200 см3 раствора, составит 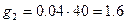 г.
г.
