Определение z* и расчет МЭ простых и сложных веществ
| Тип реакции | Вещество | Определение числа эквивалентности z* | Формула для расчета МЭ | Пример |
| Не участвует в реакции | оксид | 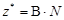 , где В – валентность элемента, N – число атомов элемента. , где В – валентность элемента, N – число атомов элемента. | 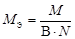 | Na2O: 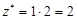 , , 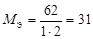 г/моль. г/моль. |
| соль | 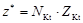 , где , где 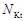 – число катионов, – число катионов, 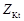 – заряд катиона. – заряд катиона. | 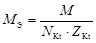 | AlCl3: 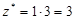 , , 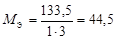 г/моль. г/моль. | |
| основание | 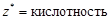 , то есть число ионов OH–, способных замещаться на анионы. , то есть число ионов OH–, способных замещаться на анионы. | 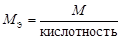 | Ca(OH)2: 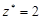 , , 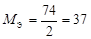 г/моль. г/моль. | |
| кислота | 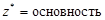 , то есть число ионов H+, способных замещаться на катионы. , то есть число ионов H+, способных замещаться на катионы. | 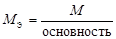 | H2SO4: 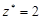 , , 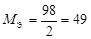 г/моль. г/моль. | |
| ионного обмена | любое | 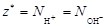 , где , где 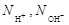 - число ионов Н+ или ОН–, переходящих от одного вещества к другому. - число ионов Н+ или ОН–, переходящих от одного вещества к другому. | 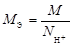 или или 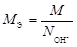 | Al(OH)3 + 2HCl = = Al(OH)Cl2 + 2H2O Для Al(OH)3: 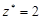 , , 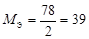 г/моль. г/моль. |
| ОВР | любое | 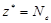 , где Ne – число электронов принятых (или отданных) окислителем (или восстановителем). , где Ne – число электронов принятых (или отданных) окислителем (или восстановителем). | 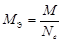 | 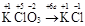 Для KClO3: Для KClO3: 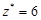 , , 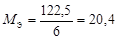 г/моль. г/моль. |
Достаточно часто уравнения химических реакций записывают в сокращенно-ионной форме. Для ионов МЭ вычисляют по формуле
МЭ(иона) = 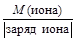 . (12)
. (12)
Закон эквивалентов:массы реагирующих друг с другом веществ, а также массы образовавшихся продуктов пропорциональны молярным массам эквивалентов этих веществ.
Математически закон эквивалентов для условной реакции вида
А + В ® С + D
можно выразить различными способами. Например:
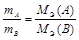 или
или 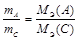 . (13)
. (13)
Если в реакции участвуют газообразные вещества, то закон эквивалентов целесообразнее записать как соотношение объемов
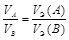 . (13а)
. (13а)
Наконец, когда один из участников реакции – газ, а другой – твердый реагент, то формула, выражающая закона эквивалентов, принимает вид
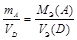 . (13б)
. (13б)
Примеры решения задач
Пример 1. Определите, сколько молекул СО образуется при сгорании 4 мг углерода. Чему равна абсолютная масса одной молекулы кислорода?
Р е ш е н и е
Составим уравнение реакции горения углерода с образованием СО
2С + О2 = 2СО ,
из которого следует, что при сгорании 2 моль углерода образуется 2 моль газа СО. Используем формулу (2) для определения количества моль углерода, которое будет равно числу моль СО
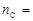
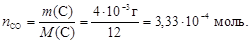
Тогда число молекул оксида углерода (II) найдем по формуле (1)
 NСО = nCO×NA = 3,33×10-4×6,02×1023 = 2,00×1020 .
NСО = nCO×NA = 3,33×10-4×6,02×1023 = 2,00×1020 .
Рассчитаем относительную молекулярную массу молекулы O2
Mr = 2× Ar(O) = 2×16 = 32 а.е.м.
Так как Mr и масса 1 моль вещества численно равны друг другу, то
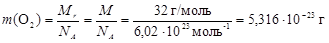 .
.
Ответ: NСО = 2×1020; 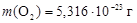 .
.
Пример 2.Сколько моль атомов азота содержится в 1 кг нитрата аммония? Определите массовую долю азота в данной соли.
Р е ш е н и е
Определяем молярную массу нитрата аммония NH4NO3
М = 2×Ar(N) + 4× Ar(H) + 3× Ar(O) = 2×14 + 4×1 + 3×16 = 80 г/моль.
Из формулы вещества NH4NO3 следует, что 1 моль нитрата аммония содержит 2 моль атомов азота, тогда
n(N) = 2×nнитрата = 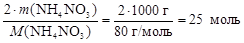 .
.
Массовую долю азота найдем как отношение двух Аr(N) к молярной массе NH4NO3
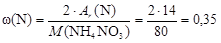 или 35 % мас.
или 35 % мас.
Ответ: число моль атомов азота равно 25 моль; w(N) = 35 % мас.
Пример 3.Выразите в молях и в граммах 6,02×1021 молекул СО2.
Р е ш е н и е
Найдем число моль молекул СО2
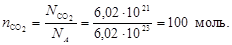
Определим массу 100 моль молекул диоксида углерода
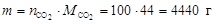 .
.
Ответ: число моль равно 100 моль; масса CO2 равна 4400 г.
Пример 4.Массовая доля фосфора в его оксиде равна 43,7 % мас. Установите простейшую формулу оксида.
Р е ш е н и е
Обозначим числа атомов фосфора и кислорода в простейшей формуле оксида через х и у. Аr данных элементов равны 31 и 16. Значит, массы фосфора и кислорода в составе оксида относятся друг к другу как 31х :16у. По условию задачи в 100 г оксида содержится 43,7 г фосфора и (100 – 43,7) = 56,3 г кислорода. Следовательно,
31х :16у = 43,7: 56,3 или х : у = 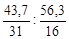 = 1,41 : 3,52 .
= 1,41 : 3,52 .
Чтобы выразить полученное соотношение целыми числами, необходимо оба значения поделить на наименьшее из них
х : у = 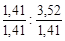 = 1 : 2,5 .
= 1 : 2,5 .
Поскольку дробные коэффициенты в химических формулах не употребляются, то оба члена последнего соотношения умножим на два
х : у = 2 : 5 .
Ответ:простейшая формула оксида фосфора Р2О5 .
Пример 5.Вычислите относительную плотность пропана по водороду и по воздуху.
Р е ш е н и е
Используем второе следствие закона Авогадро. Тогда по формуле (4) плотности пропана С3Н8 по водороду Н2 и воздуху соответственно равны
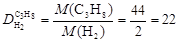 ,
, 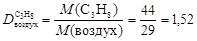
Ответ: 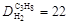 ;
; 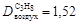 .
.
Пример 6.При температуре 280 К в сосуде объемом 14 дм3 находится 8 г водорода и 0,25 моль азота. Определите общее давление в системе и парциальные давления каждого газа. Вычислите мольные, объемные и массовые доли компонентов в имеющейся смеси.
Р е ш е н и е
По формуле (2) найдем число моль водорода в смеси:
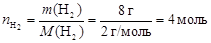 .
.
По формуле (7) рассчитаем парциальные давления газов:
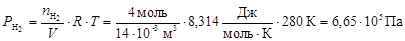 ,
,
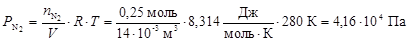 .
.
Общее давление смеси найдем по формуле (6)
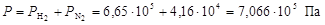 .
.
Рассчитаем массовые доли компонентов
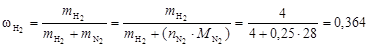 ;
; 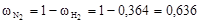 .
.
Вычислим мольные доли газов в смеси
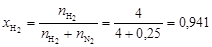 ;
; 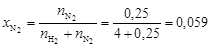 .
.
Для оценки объемных долей газов найдем объемы H2 и N2 по формуле (5)
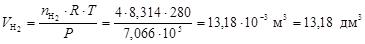 ,
,
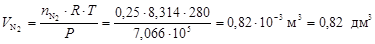 .
.
Тогда объемные доли водорода и азота соответственно равны
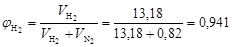 ;
; 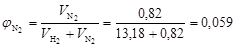 .
.
Таким образом, численные значения объемной и мольной доли для газов совпадают, так как выполняется закон Авогадро.
Ответ: 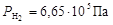 ;
; 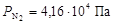 ;
; 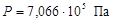 ;
; 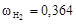 ;
; 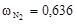 ;
; 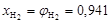 ;
; 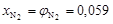 .
.
Пример 7.Какой объем займет смесь газов, содержащая 14 г азота, 32 г кислорода и 35,5 г хлора, при нормальных условиях и в условиях, когда температура возрастет на 20 К, а давление – на 0,5 атм?
Р е ш е н и е
Определим общее число моль газов в смеси:
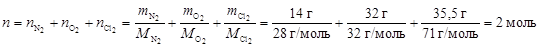 .
.
По первому следствию закона Авогадро объем смеси газов при н.у.
V° = n× V 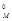 = 2 × 22,4 = 44,8 дм3 .
= 2 × 22,4 = 44,8 дм3 .
Определим температуру и давление в новых условиях
Т = 273 + 20 = 293 К; Р = 1 + 0,5 = 1,5 атм = 1,5× 101325 = 151987,5 Па.
Тогда из формулы (5) найдем объем газовой смеси
V = 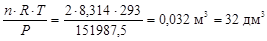 .
.
Ответ: V° = 44,8 дм3; V = 32 дм3.
Пример 8. Вычислите МЭ элементов в соединении CS2 и молярные эквивалентные массы веществ Al и SO3.
Р е ш е н и е
Найдем С.О. элементов в сероуглероде 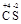 2. Тогда по формуле (9)
2. Тогда по формуле (9)
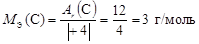 ,
, 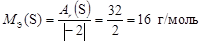 .
.
Алюминий в соединениях проявляет постоянную валентность В = 3, тогда по формуле (10)
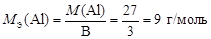 .
.
Валентность серы в оксиде SO3 равна В = 6, а число атомов S N = 1, тогда
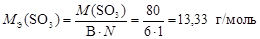 .
.
Ответ: 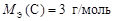 ;
; 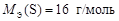 ;
; 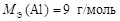 ;
; 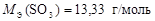 .
.
Пример 9.Определите МЭ ортофосфорной кислоты и гидроксида марганца, участвующих в реакциях:
1) Н3PO4 + 2KOH = K2HPO4 + 2H2O;
2) Mn(OH)2 + Cl2 + 2KOH = MnO2 + 2KCl + 2H2O .
Р е ш е н и е
Реакция 1) является ионно-обменной, так как протекает без изменения С.О. элементов. В данном случае от 1 моль Н3PO4 к молекулам KOH переходит два иона Н+, т.е. 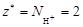 . Тогда
. Тогда
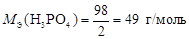 .
.
Реакция 2) – это окислительно-восстановительный процесс. С.О. атома Mn в гидроксиде равна +2, а в продукте реакции она составляет +4. Атом марганца теряет два электрона в процессе окисления, тогда 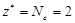 , а
, а
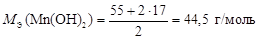 .
.
Ответ: 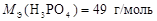 ;
; 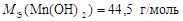 .
.
Пример 10. Вычислите молярный эквивалентный объем О2 и Н2 при н.у.
Р е ш е н и е
Э(Н) = 1 по определению. Чаще всего С.О. кислорода в сложном веществе равна –2, поэтому Э(О) = 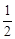 . Газы Н2 и О2 состоит из двух атомов, тогда по формуле (11)
. Газы Н2 и О2 состоит из двух атомов, тогда по формуле (11)
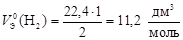 ;
; 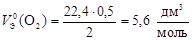 .
.
Ответ: 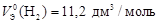 ;
; 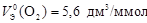 .
.
Пример 11. При сгорании 5 г металла образуется 9,44 г оксида металла. Вычислите молярную эквивалентную массу металла. Определите относительную атомную массу металла, если его валентность в оксиде В = 3.
Р е ш е н и е
