Метод дигестии. Проведение анализа
Навеску измельченного и отделенного от косточек сырья массой (50,00±0,02) г или (100,010,1) г без потерь переносят в мерную колбу вместимостью 500 см3.Остаток сока и мезги тщательно смывают в колбу, содержимое ее доливают дистиллированной водой до 3/4 объема и в колбу помещают термометр. Колбу устанавливают в водяную баню и в течение 2 ч при температуре (80±2)°С проводят экстрагирование при частом перемешивании. После этого колбу вынимают из водяной бани, охлаждают и объем раствора в колбе доводят до метки дистиллированной водой при температуре 20 0С. Содержимое тщательно перемешивают и фильтруют через бумажный складчатый фильтр.
Полученный прозрачный фильтрат тщательно перемешивают и определяют в нем содержание растворимых сухих веществ (экстракта) с применением рефрактометра по инструкции, приложенной к прибору.
При расчете массовой доли экстракта в плодово-ягодном сырье необходимо вносить поправки на содержание косточек (для сырья, содержащего косточки) и на объем нерастворимых сухих веществ, содержащихся в сырье.
Для свежего сырья принимают среднюю поправку на объем нерастворимых сухих веществ, равную 0,06 см3 на 1 г плодов или ягод, взятых на дигестию. Следовательно, при дигестии 100 г сырья в колбе вместимостью 500 см3 поправка на объем нерастворимых сухих веществ составляет 0,06-100 = 6 см3. Объем содержимого колбы принимают равным 500 - 6 = 494 см3.
Содержание растворимых сухих веществ в плодово-ягодном сырье вычисляют по формуле (1.2):
Сэк = 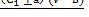 , (1.2)
, (1.2)
где Сэк - массовая доля растворимых сухих веществ в сырье, %;
С1- массовая доля растворимых сухих веществ в растворе после дигестии, % (по рефрактометру);
V - объем колбы, в которой проводили дигестию, см3;
в - поправка на объем, занимаемый сухим нерастворенным веществом сырья;
а - поправка к показанию рефрактометра на температуру;
m - масса взятой навески сырья для дигестии, г.
Пример. Определяли массовую долю растворимых сухих веществ в свежей вишне. Для дигестии было взято 100 г вишни (без косточек). Дигестию проводили в колбе вместимостью 500 см3. Содержание растворимых сухих веществ в отфильтрованном растворе по рефрактометру составило 2,3 г/100 см3 при температуре 21 °С. Поправка на температуру (см. справочную таблицу) для показания 2,3% равна 0,065. Вишня содержала 10% косточки. Подставляя соответствующие значения в приведенную выше формулу (1.2), получили, что массовая доля экстракта в вишне:
Сэк = 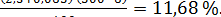
После внесения поправки на содержание косточки, массовая доля экстракта составила Сэк = 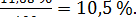
Задание 5 Определить массовую долю титруемых кислот
Метод основан на нейтрализации кислоты, содержащейся в анализируемом сырье, раствором гидроксида натрия в присутствии индикатора фенолфталеина.
Для определения титруемой кислотности в свежем плодово-ягодном сырье используют отфильтрованный раствор, полученный методом дигестии при определении растворимых сухих веществ.
Проведение анализа
5-10 см3 фильтрата (в зависимости от интенсивности окраски) помещают в коническую колбу вместимостью 200 см3, добавляют 50-100 см3 свежепрокипяченной дистиллированной воды и 3 капли индикатора фенолфталеина и титруют раствором гидроксида натрия концентрации 0,1 моль/дм3 до появления розового окрашивания, не исчезающего в течение 1 мин.
Если титруемый раствор окрашен, то в качестве индикатора используют синюю лакмусовую бумажку. Титрование считают законченным, когда лакмусовая бумажка при нанесении на нее стеклянной палочкой капли титруемого раствора перестанет изменять окраску.
Результаты относят к взятой для экстрагирования навеске, а содержание кислот пересчитывают на лимонную кислоту.
Молекулярная масса лимонной кислоты 192, моногидрата 210.
Следовательно, 1 моль-экв лимонной кислоты равен 192/3 = 64 г.
1 см3 раствора гидроксида натрия концентрации 0,1 моль/дм3 соответствует 0,0064 г лимонной кислоты или 0,007 г моногидрата лимонной кислоты.
Массовую долю титруемых кислот в плодово-ягодном сырье (%) при использовании для анализа фильтрата, полученного после дигестии, рассчитывают по формулам (1.3) и (1.4):
Стк = 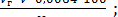 (1.3)
(1.3)
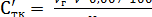 , (1.4)
, (1.4)
где Vг - объем раствора гидроксида натрия, концентрации 0,1 моль/дм3, пошедшего на титрование, см3;
V - объем фильтрата после дигестии, см3;
Vг - объем фильтрата, взятого на титрование, см3;
а - навеска сырья, взятая на анализ, г.
Поскольку на проведение дигестии всегда берется 100 г сырья, то объем фильтрата равен 494 см3. Подставляя эти постоянные значения в уравнения и проведя сокращения, получаем (1.5), (1.6):
Стк = 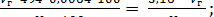 (1.5)
(1.5)
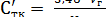 , (1.6)
, (1.6)
Для определения титруемой кислотности в косточковых плодах и ягодах необходимо учесть содержание косточек. Содержание кислот рассчитывают на исходное сырье по уравнению (1.7), (1.8):
Стк = 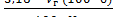 , (1.7)
, (1.7)
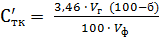 , (1.8)
, (1.8)
где б - содержание косточек в сырье, %.
За окончательный результат анализа принимают среднее арифметическое результатов двух параллельных определений, округленный до первого десятичного знака, расхождение между которыми не должно превышать 0,2 %
Пример. Анализировали содержание титруемых кислот в вишне. Содержание косточек в ней составило 8,2%. Отобрано 10 см3 фильтрата, на титрование которого израсходовано 3,5 см3 раствора гидроксида натрия концентрации 0,1 моль/дм3.
Массовая доля титруемых кислот в вишне составила:
Стк = 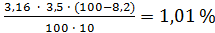 .
.
Задание 6 Сравнить полученные результаты анализов расти-тельного сырья с нормативными значениями [9]. Сделать выводы
Задание 7 Изучить формы журналов приготовления ликероводочных изделий ПЛВ №№ 1, 2, 3, 4
Изучить форму и заполнить соответствующие графы журналов по результатам анализа растительного сырья (формы журналов выдаются преподавателем):
- журнал ПЛВ № 1 приготовления плодоовощных спиртованных соков;
- журнал ПЛВ № 2 приготовления морсов;
- журнал ПЛВ № 3 приготовления настоев;
- журнал ПЛВ №4 приготовления ароматных спиртов.
Задание 8 Приготовить спиртованные морсы из свежего и сушеного плодово-ягодного сырья и спиртованные настои и ароматные спирты из эфирно-масличного сырья
Под руководством преподавателя выполнить расчет и осуществить залив спиртованных морсов и спиртованных настоев и настоя для приготовления ароматного спирта согласно действующей нормативной документации. Заполнить в лабораторном журнале рапорт на залив спиртованных морсов и настоев.
Вопросы для контроля:
1. Какие виды растительного сырья используются в ликероводочной промышленности?
2. Какова схема контроля качества растительного сырья?
3. Каким образом осуществляется отбор проб свежего и сушеного плодово-ягодного и сушеного эфирно-масличного сырья?
4. Какими методами можно определить массовую долю влаги в растительном сырье? Расскажите методику определения массовой доли влаги в растительном сырье методом высушивания до постоянной массы
5. Расскажите каким образом определить содержание общего экстракта в свежем плодово-ягодном сырье методом дигестии.
6. Каким образом определяется титруемая кислотность в плодово-ягодном сырье? В чем она выражается?
Лабораторная работа №2
АНАЛИЗ ВОДЫ
Цель работы: изучить требования, предъявляемые к качеству питьевой воды и исправленной воды, используемой для приготовления ликероводочных изделий, освоить физико-химические методы анализа воды.
Аппаратура и реактивы:
- весы аналитические;
- чашки выпарительные фарфоровые объемом 250 см3;
- индикаторы синяя и красная лакмусовая бумажки, метиловый оранжевый, фенолфталеин;
- рН-метр;
- иодид калия, крахмал, метиловый оранжевый;
- 0,1 М раствор соляной кислоты;
- 0,01 н раствор перманганата калия, 0,01 н раствор щавелевой кислоты;
- электрическая плитка, водяная баня, термометр;
- лабораторная посуда, бюретки;
- сульфат кобальта, бихромат калия, серная кислота (плотностью 1,84 г/мл), набор цилиндров Несслера, фотоэлектроколориметр;
- воронки, бумажный фильтр;
- дистиллированная вода;
Задание 1 По учебной и справочной литературе изучить требования, предъявляемые к качеству питьевой воды и воды для приготовления ликероводочных изделий
Качеству воды в ликероводочном производстве уделяется большое внимание, поскольку она, наряду с этиловым спиртом, является главной составной частью всех изделий и водок и оказывает существенное влияние на органолептические показатели готовой продукции.
Как правило, вода на ликероводочные заводы поступает из водопровода и качество ее должно удовлетворять требованиям ГОСТ 2874-82 «Вода питьевая» и требованиям СанПиН 2.1.4.1074-01 «Вода питьевая». Однако, вода, используемая для изготовления водок и ликероводочных изделий, не по всем показателям качества, изложенным в данном стандарте, удовлетворяет необходимым требованиям. В связи с этим применяются дополнительные методы обработки воды.
Общая жесткость воды для приготовления ликероводочных изделий не должна превышать при использовании естественной 1 ммоль-экв/дм3 и умягченной воды 0,2 ммоль-экв/ дм3. В используемой неумягченной воде сухой остаток должен быть не выше 500 мг/дм3, щелочность не более 4,0 см3 0,1 М НСl на 100 см3 воды.
Схема контроля качества воды, выполняемого на ликероводочных заводах, представлена в таблице 2.1.
Таблица 2.1 Схема контроля качества воды, поступающей на производство
| Наиме- нование объекта контроля | Отбор проб | Анализируемый показатель | Метод анализа | ||
| место | количество | периодич- ность | |||
| Вода питьевая исходная из горво- допрово- да или артсква-жины | напор ный чан | 3 дм3 | 1 раз в квартал | запах, вкус, | органолептический |
| привкус | |||||
| цветность | колориметрический | ||||
| мутность | визуальный | ||||
| реакция воды | визуальный с индикатором | ||||
| сухой остаток | весовой | ||||
| окисляемость | титриметрический | ||||
| щелочность | то же | ||||
| окись кальция | то же | ||||
| окись магния | то же | ||||
| общая жесткость | комплексонометрический | ||||
| остаточный активный хлор | титриметрический | ||||
| азотистая кислота | визуальный | ||||
| азотная кислота | то же | ||||
| железо | фотоэлектроколориметри-ческий | ||||
| хлориды | то же | ||||
| сульфаты | то же | ||||
| кремний | то же | ||||
| Вода в процессе исправления | трубо провод | 0,5 дм3 | через каждые 2 ч, к концу заботы фильтра через 1 ч | щелочность | титриметрический |
| общая жесткость | комплексонометрический | ||||
| Исправленная вода | Напорный чан | 0,5 дм3 | по мере наполнения | щелочность | титриметрический |
| общая жесткость | комплексонометрический |
При выполнении лабораторной работы подгруппа делится на две бригады, каждая из которых отбирает и анализирует один образец воды.
Задание 2 Отбор проб
Для определения качества питьевой воды, поступающей в производство, отбирают среднюю пробу воды по ГОСТ 24481-80.
Пробы воды отбирают в химически чистые сосуды с пришлифованными пробками (допускаются корковые или полиэтиленовые), изготовленные из прочного, бесцветного химически стойкого стекла, или в полиэтиленовые сосуды, разрешенные для контакта с питьевой водой. Пробы, предназначенные для анализа органических веществ, отбирают только в стеклянные сосуды с пришлифованными пробками.
Отбор пробы проводят после спуска воды в течение не менее 15 мин при полностью открытом кране.
Перед отбором пробы сосуд не менее двух раз ополаскивают водой, подлежащей исследованию. Сосуд заполняют водой до верха. Перед закрытием сосуда пробкой верхний слой сливают так, чтобы под пробкой оставался слой воздуха объемом 5-10 см3. Вода должна быть подвергнута исследованию в день отбора пробы. Если анализ нельзя выполнить сразу, воду хранят при температуре, близкой к 0°С, не допуская замерзания. Продолжительность хранения не должна превышать 72 ч с момента отбора пробы. Такие предосторожности необходимо соблюдать, чтобы не изменилось качество воды при хранении в результате развития микроорганизмов, выщелачивания стекла и др.
Пробы воды для определения органолептических показателей не консервируют. Определение проводят не позднее 2 ч с момента отбора пробы.
Для проведения химического анализа отбирают пробу воды в количестве не менее 3 дм3.
Воду, поступающую на завод, отбирают из трубопровода перед водоочистительной станцией, предварительно спустив некоторое ее количество в течение 10-15 мин для промывки трубопроводов.
На склянку с водой наклеивают этикетку с указанием наименования источника, даты отбора пробы, метеорологических условий, температуры воды при отборе, цели исследования воды, с подписями должностных лиц, отобравших пробу.
Задание 3 Определить органолептические свойства воды
Органолептическими методами определяют характер и интенсивность запаха, вкуса, привкуса, цвет и мутность воды.
3.1 Определение запаха
Характер запаха воды определяют ощущением воспринимаемого запаха (землистый, хлорный, нефтепродуктов и пр.) при температуре 20 и 60 °С и оценивают по пятибалльной системе согласно таблице 2.2.
Таблица 2.2 Оценка запаха воды
| Интенсивность запаха | Характер проявления запаха | Оценка интенсивности запаха, балл |
| Нет | запах не ощущается | |
| Очень слабая | запах не ощущается потребителем, но обнаруживается при лабораторном исследовании | |
| Слабая | запах замечается потребителем, если обратить на это внимание | |
| Заметная | запах легко замечается и вызывает неодобрительный отзыв о воде | |
| Отчетливая | запах обращает на себя внимание и заставляет воздержаться от питья | |
| Очень сильная | запах настолько сильный, что делает воду непригодной для употребления |
3.1.1 Определение запаха при температуре 20 °С
В колбу с пришлифованной пробкой вместимостью 250-350 см3 отмеривают 100 см3 анализируемой воды при температуре 20 °С. Колбу закрывают пробкой, содержимое ее несколько раз перемешивают вращательными движениями. Во время вращения колбу держат за плоское дно, придерживая пальцем пробку, что сводит к минимуму выход запаха перед определением. Затем открывают пробку и определяют запах при вдыхании обычным способом, сравнивая с колбой, содержащей воду без запаха.
3.1.2 Определение запаха при температуре 60 °С
В колбу отмеривают 100 см3 анализируемой воды. Горлышко колбы закрывают часовым стеклом и подогревают на водяной бане до температуры 50-60 °С.
Содержимое колбы несколько раз перемешивают вращательными движениями. Сдвигая стекло в сторону, быстро определяют характер и интенсивность запаха и оценивают по пятибалльной системе согласно таблице 2.2.
3.2 Определение вкуса и привкуса
Органолептическим методом определяют характер и интенсивность вкуса и привкуса.
Различают четыре основных вида вкуса: соленый, кислый, сладкий, горький. Все другие виды вкусовых ощущений относят к привкусам.
Анализируемую воду набирают в рот малыми порциями, не проглатывая, задерживают 3-5 с. Для сравнения используют воду из другой колбы. Интенсивность вкуса и привкуса определяют при температуре 20 °С и оценивают по пятибалльной системе согласно требованиям, указанным в таблице 2.3.
Таблица 2.3 Оценка вкуса и привкуса воды
| Интенсивность вкуса и привкуса | Характер проявлений вкуса и привкуса | Оценка интенсивности вкуса и привкуса, балл |
| Нет | вкус и привкус не ощущается | |
| Очень слабая | вкус и привкус не ощущается потребителем, но обнаруживается при лабораторном исследовании | |
| Слабая | вкус и привкус замечаются потребителем, если обратить на это его внимание | |
| Заметная | вкус и привкус легко замечается и вызывает неодобрительный отзыв о воде | |
| Отчетливая | вкус и привкус обращают на себя внимание и заставляют воздержаться от питья | |
| Очень сильная | вкус и привкус настолько сильны, что делают воду непригодной для употребления |
3.3 Определение мутности
Мутность воды определяют визуально путем сравнения проб анализируемой воды с чистой дистиллированной водой.
Определение проводят в цилиндрах из бесцветного одинакового стекла высотой 30-40 см и диаметром 3-4 см. В один из цилиндров наливают анализируемую, в другой - чистую дистиллированную воду. Для получения сопоставимых результатов слой воды в цилиндрах должен быть одинаковой высоты.
Цилиндры устанавливают на матовое стекло или на белый лист бумаги, устанавливают боковое освещение (затемняют цилиндры каким-либо экраном черного цвета) и сравнивают визуально мутность исследуемой и дистиллированной воды. Результаты выражают словами: вода прозрачная, едва заметная муть, слабая муть, значительная и весьма сильная.
3.4 Определение цветности
Цветность воды определяют фотометрически - путем сравнения проб испытуемой жидкости с растворами, имитирующими цвет природной воды.
Реактивы: Основной стандартный раствор (раствор 1). 0,0875 г бихромата калия К2Сг207, 2,0 г сульфата кобальта CoS04-7H20 и 1 см серной кислоты (относительной плотностью 1,84) растворяют в дистиллированной воде и доводят объем раствора до 1 дм3. Раствор соответствует цветности 500°.
Разбавленный раствор серной кислоты (раствор 2). 1 см3 концентрированной серной кислоты (относительной плотностью 1,84) переносят в мерную колбу вместимостью 1 дм3. Объем раствора в колбе доводят до метки дистиллированной водой.
Приготовление шкалы цветности. Для приготовления шкалы цветности используют набор цилиндров Несслера вместимостью 100 см3.
В каждом цилиндре смешивают растворы 1 и 2 в соотношении, указанном на шкале цветности (таблица 2.4).
Раствор в каждом цилиндре соответствует определенному градусу цветности. Растворы, приготовленные по шкале цветности, хранят в темном месте. Через каждые 2-3 месяца их заменяют.
Таблица 2.4 Шкала цветности
| Раствор 1, см3 | |||||||||||
| Раствор 2, см3 | |||||||||||
| Градусы цветности |
Проведение анализа
В цилиндр Несслера отмеряют 100 см3 профильтрованной через мембранный фильтр №4 анализируемой пробы воды и сравнивают со шкалой цветности, производят просмотр сверху вниз на белом фоне. Если анализируемая проба воды имеет цветность выше 70°, пробу следует разбавить дистиллированной водой в определенном соотношении до получения окраски анализируемой воды, сравниваемой с окраской шкалы цветности. Полученный результат умножают на число, соответствующее степени разбавления.
Более точное определение цвета можно провести с помощью фото-электроколориметра. При этом предварительно по шкале цветности строят градуировочный график, откладывая по оси абсцисс значения цветности, а по оси ординат - соответствующую величину оптической плотности растворов.
Оптическую плотность растворов измеряют в кюветах с толщиной рабочей грани 5-10 мм в синей части спектра, при длине волны 440 нм, в сравнении с контрольным раствором. Контрольным раствором служит дистиллированная вода, профильтрованная через мембранный фильтр №4.
Цветность анализируемой воды определяют по градуировочному графику и выражают в градусах цветности.
Задание 4 Определить физико-химические показатели
4.1 Определение реакции воды
Анализ проводят в двух фарфоровых чашках. В одну наливают дистиллированную, а в другую - анализируемую воду. В обе чашки погружают полоски лакмусовой бумажки и выдерживают там 15-20 мин, затем вынимают и сравнивают их между собой. Посинение лакмусовой бумажки указывает на щелочность воды, а покраснение - на кислотность. Нормальная реакция естественных вод должна быть слабощелочной на лакмус.
В пробирку с испытуемой водой добавляют 3 - 5 капель индикатора и наблюдают за окраской.
Вода, желтая с метиловым оранжевым и розовая с фенолфталеином, содержит ионы ОН- и СО32- и не содержит ионы Н+.
Вода бесцветная с фенолфталеином и оранжевая с метиловым оранжевым, содержит ионы Н+ и не содержит ионов ОН- и СО32-.
Значение рН воды определяют с помощью рН-метра.
4.2 Определение сухого остатка
Сухой остаток в воде определяют взвешиванием массы остатка после выпаривания испытуемой воды на водяной бане. Определение содержания сухого остатка проводится с добавлением и без добавления безводного карбоната натрия.
Определение сухого остатка методом высушивания без добавления безводного карбоната натрия: 250 см3 профильтрованной воды выпаривают в фарфоровой чашке, предварительно высушенной по постоянной массы. Выпаривание ведут на водяной бане с дистиллированной водой. Затем чашку с сухим остатком помещают в термостат при температуре 110 °С и сушат до постоянной массы. После охлаждения в эксикаторе чашку с содержимым взвешивают. Массу осадка умножают на 4 и находят содержание сухого остатка в испытуемой воде (мг/дм3).
Пример. Масса пустой чашки - 35,8630 г, масса чашки с осадком -35,9740 г. Масса осадка: 35,9740 - 35,8630 = 0,111 г. Содержание сухого остатка 0,111-4 = 0,444 г/дм3, или 444 мг/дм3.
Данный метод определения сухого остатка дает несколько завышенные результаты вследствие гигроскопичности хлоридов магния и кальция и трудной отдачи кристаллизационной воды сульфатами этих металлов. Эти недостатки устраняются прибавлением к выпариваемой воде химически чистого карбоната натрия. При этом хлориды, сульфаты кальция и магния переходят в безводные карбонаты, а из натриевых солей лишь сульфат натрия имеет кристаллизационную воду, но она полностью удаляется высушиванием сухого остатка при температуре 150-180 °С.
4.3 Определение щелочности
Щелочность воды обусловливается содержанием в ней гидроксидов калия, натрия, солей щелочных, щелочноземельных металлов, а также аммиака.
Щелочность воды характеризуется количеством раствора соляной кислоты, необходимым для доведения 100 см3 воды до нейтральной реакции. Щелочность выражают в мг-экв/дм3 или в см3 раствора соляной кислоты концентрации 0,1 моль/дм3 на 100 см3 воды.
Щелочность воды определяют путем ее титрования с двумя индикаторами: сначала с фенолфталеином, а затем с метиловым оранжевым (или со смешанным индикатором). В первом случае определяют гидратную щелочность, во втором - общую.
Проведение анализа
В коническую колбу вместимостью 250 см3 вносят 100 см3 анализируемой воды, приливают три капли раствора фенолфталеина и осторожно (по каплям) титруют при помешивании раствором соляной кислоты концентрации 0,1 моль/дм3 до обесцвечивания.
Объем кислоты, израсходованный на титрование воды с фенолфталеином, характеризует гидратную щелочность, которая определяется по формуле (2.1):
ТГ = V1 · К (2.1),
где: ТГ - гидратная щелочность по фенолфталеину;
V1 - объем раствора соляной кислоты концентрации 0,1 моль/ дм3, израсходованный на титрование воды, см3;
К - поправочный коэффициент к концентрации раствора соляной кислоты.
Отмечают объем соляной кислоты, израсходованной на титрование. К обесцвеченной реакционной жидкости добавляют 3-4 капли метилового оранжевого и продолжают титрование до перехода окраски раствора из желтой в оранжевую.
Реакция идет по уравнению: Na2C03 + 2НС1 = 2NaCl + Н20 + С02.
Обработка результатов
Общий объем раствора соляной кислоты, концентрации 0,1 моль/дм3, израсходованный на титрование с обоими индикаторами, характеризует общую щелочность воды (Тобш), которая определяется по формуле:
Тобш = (V1+V2)·K (2.2)
где V2 - объем раствора соляной кислоты, концентрации 0,1 моль/дм3, израсходованный на титрование воды с метилоранжем, см3.
Пример. На анализ взято 100 см3 воды. Объем раствора соляной кислоты (V1), израсходованный на титрование воды с фенолфталеином, составил 2,5 см3. На титрование того же объема воды с метиловым оранжевым израсходовано 1,0 см3 раствора соляной кислоты (V2). Поправочный коэффициент к раствору кислоты равен 1,0.
Общая щелочность (см3 раствора соляной кислоты концентрации 0,1 моль/дм3) Тобш = (2,5 + 1,0)1,0 = 3,5 см3/100 см3.
4.4 Определение содержания органических веществ (перманганатная окисляемость)
Показатель окисляемости воды характеризует содержание в ней органических веществ, способных к окислению. Окисляемость выражается в расходе перманганата калия или молекулярного кислорода в миллиграммах на 1 дм3 воды. При этом 4 мг перманганата калия примерно соответствует 1 мг кислорода.
Метод определения окисляемости воды основан на окислении веществ, присутствующих в пробе воды, раствором перманганата калия концентрацией 0,01 моль/дм3 в кислой среде при кипячении.
Без разбавления можно определять окисляемость до 10 мг 02/дм3 воды. Наивысшее допустимое разбавление проб - десятикратное, т. е. метод можно использовать только для проб, окисляемость которых ниже 100 мг 02/дм3 воды.
При определении окисляемости, дающей представление о содержании в пробе окисляемых органических веществ, необходимо устранить влияние неорганических соединений, которые могут быть окисленными при определении. К таким соединениям относятся хлориды, сульфаты, нитраты, железо (II). Когда концентрация хлоридов даже после разбавления пробы превышает 300 мг/дм3, прибавляют 0,4 г сульфата ртути (II).
Железо (II), сероводород, сульфаты и нитраты следует определять отдельно, а результат, пересчитанный на окисляемость (мг 02/дм3), необходимо вычесть из найденной величины окисляемости пробы:
- 1 мг H2S соответствует 0,47 мг 02;
- 1 мг N02 соответствует 0,35 мг 02;
- 1 мг Fе2+соответствует 0,14 мг 02.
Для разбавления проб применяют дистиллированную воду, не содержащую окисляющих веществ.
Проведение анализа
В колбу вносят 100 см3 пробы (после двухчасового отстаивания) или меньшее ее количество, доведенное до 100 см3 дистиллированной водой для разбавления, приливают 5 см3 разбавленной серной кислоты и 10 см3 раствора перманганата калия концентрации 0,01 моль/дм3.
Смесь нагревают так, чтобы она закипела через 5 мин, и кипятят точно 10 мин. К горячему раствору прибавляют 10 см3 раствора щавелевой кислоты концентрации 0,01 моль/дм3. Обесцвеченную смесь титруют горячим (лучше при 80-90 °С) раствором перманганата калия до розового окрашивания. Температура смеси при титровании не должна падать ниже 80 °С. Израсходованный объем раствора КМп04 измеряют с точностью до 0,05 см3.
Одновременно готовят контрольный опыт с водой для разбавления.
Если раствор при кипячении обесцветится или побуреет, определение повторяют с разбавленной пробой. Определение повторяют и тогда, когда раствора КМп04 расходуется более 60% добавленного в пробу количества, т. е. расход на титрование превышает 6 см3. При титровании разбавленных проб не должно быть израсходовано меньше 20% добавленного в пробу количества перманганата калия, т. е. меньше 2 см3.
Для контрольной пробы отмеривают 100 см3 воды для разбавления и обрабатывают ее так же, как и анализируемую пробу. Расход раствора перманганата калия концентрацией 0,01 моль/дм3 не должен превышать 0,2 см3.
Окисляемость (мг/дм3) вычисляют по формуле (2.3):
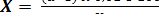 =
= 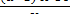 , (2.3)
, (2.3)
где а - объем раствора перманганата калия, израсходованного на титрование основной пробы, см3;
в- объем раствора перманганата калия, израсходованного на титрование контрольной пробы, см3;
К - поправочный коэффициент к раствору;
8 - эквивалент кислорода;
V- объем пробы, взятой для анализа, см3.
Результаты округляют с точностью до 0,1 при значениях окисляемости от 0 до 10 мг 02/дм3 и до 1 при значениях от 10 до 100 мг 02/дм3.
4.5 Определение общей жесткости воды
Общая жесткость воды обусловлена содержанием в ней растворимых солей кальция и магния и выражается в мг-экв/дм3. 1 мг-экв жесткости соответствует содержанию 20,04 мг/дм3 иона кальция или 12,16 мг/дм3 иона магния. Эти величины получены делением атомной массы Са (40,08) и Mg (24,32) на 2 (валентность) и 1000 (перевод г в мг).
Для определения малых величин жесткости принят мкг-экв/дм3, который равен 0,001 мг-экв/дм3.
Жесткость воды можно выразить в градусах. Один немецкий градус равен 1 мг СаО в 100 см3 воды и обозначается буквой «Н».
1 мг-экв/дм3 равен 2,804 °Н жесткости, что видно из следующего расчета: 1 мг-экв содержит в 1 дм3 20,04 мг Са или 28,04 мг СаО.
1 °Н жесткости соответствует 10 мг СаО в 1 дм3. Следовательно, 1 мг-экв/дм3 равен: 28,04 : 10 = 2,804 °Н жесткости.
Жесткость различают устранимую, постоянную и общую.
Устранимая (временная, или карбонатная жесткость) обусловлена гидрокарбонатными солями кальция и магния. При кипячении эти соли переходят в карбонаты и выпадают в осадок, вследствие чего жесткость воды уменьшается.
Постоянная жесткость обусловлена солями сильных кислот (MgCl2, CaS04), которые при кипячении из раствора не удаляются.
Общая жесткость воды представляет собой сумму устранимой и постоянной жесткости.
Для определения жесткости воды применяется комплексонометрический метод.
В основу этого метода положена способность двунатриевой соли этилендиаминтетрауксусной кислоты (трилона Б) образовывать прочные комплексные соединения с ионами кальция и магния.
Если определение жесткости не может быть проведено в день отбора пробы, то отмеренный объем воды, разбавленный дистиллированной водой в соотношении 1:1, допускается оставлять до следующего дня.
Пробы воды, предназначенные для определения общей жесткости, не консервируются.
Проведение анализа
Определению общей жесткости воды препятствуют медь, цинк, марганец и высокое содержание углекислых и двууглекислых солей. Влияние этих веществ устраняется в ходе анализа.
Точность определения при титровании 100 см3 составляет 0,05 мг-экв/дм3.
В коническую колбу вносят 100 см3 отфильтрованной анализируемой воды или меньший объем, разбавленный до 100 см3 дистиллированной водой. Затем прибавляют 5 см3 буферного раствора, 5-7 капель индикатора или приблизительно 0,1 г сухой смеси индикатора хромоген-черного с сухим хлоридом натрия и сразу же титруют при сильном взбалтывании раствором трилона Б концентрацией 0,05 моль/дм3 до изменения окраски в эквивалентной точке (окраска должна быть синей с зеленоватым оттенком).
Если на титрование было израсходовано больше 10 см3 раствора трилона Б концентрации 0,05 моль/дм3, то это указывает на суммарное содержание в отмеренном объеме воды ионов кальция и магния, превышающее 0,5 мг-экв. В таких случаях следует определение повторить, взяв меньший объем воды и разбавив его до 100 см3 дистиллированной водой.
Нечеткое изменение окраски в эквивалентной точке указывает на присутствие меди и цинка. Для устранения влияния этих веществ к отмеренной для титрования пробе воды прибавляют 1-2 см3 раствора сульфида натрия, после чего проводят испытание, как указано выше.
Если после прибавления к отмеренному объему воды буферного раствора и индикатора титруемый раствор постепенно обесцвечивается, приобретая серый цвет, что указывает на присутствие марганца, то к пробе воды, отобранной для титрования, до внесения реактивов следует прибавить 5 капель раствора солянокислого гидроксиламина массовой концентрации 1 г/100 см3 и определять жесткость, как указано выше.
Если титрование приобретает затяжной характер с неустойчивой и нечеткой окраской в эквивалентной точке, что наблюдается при высокой щелочности воды, отобранной для титрования, то до внесения реактивов следует прибавить раствор серной кислоты концентрации 0,1 моль/дм3 в количестве, необходимом для нейтрализации щелочности воды, с последующим кипячением или продуванием раствора воздухом в течение 5 мин. После этого прибавляют буферный раствор, индикатор и далее определяют жесткость, как указано выше.
Общую жесткость воды (мг-экв/дм3) вычисляют по формуле (2.4):
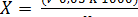 , (2.4)
, (2.4)
где V - объем раствора трилона Б, израсходованный на титрование, см3;
К - поправочный коэффициент к нормальности раствора трилона Б;
V1 - объем воды, взятой на определение, см ;
0,05 - концентрация раствора трилона Б, моль/дм3.
Расхождение между повторными определениями не должно превышать 2%.
4.6 Определение остаточного активного хлора
Свободный хлор в воде определяется качественно и количественно. Определение следует проводить немедленно после отбора пробы.
4.6.1 Качественное определение свободного хлора.
В стакан или фарфоровую чашку наливают 200-300 см3 испытуемой воды, приливают к ней 5 см3 раствора серной кислоты концентрации 25 г/100 см3, 5 см3 раствора йодида калия концентрации 10 г/100 см3 и 2-3 см3 1% -го раствора крахмала. При наличии в воде свободного (растворенного) хлора раствор синеет.
4.6.2 Количественное определение остаточного активного хлора титрованием метиловым оранжевым
Метод основан на окислении свободным хлором метилового оранжевого.
Проведение анализа
100 см3 анализируемой воды помещают в коническую колбу вместимостью 250 см3, добавляют 2-3 капли раствора соляной кислоты концентрации 5 моль/дм3 и при помешивании быстро титруют раствором метилового оранжевого концентрации 0,005 г/100 см3 до появления неисчезающей розовой окраски.
Массовую концентрацию свободного остаточного хлора (мг/дм3) вычисляют по формуле (2.5):
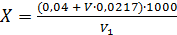 , (2.5)
, (2.5)
где V - объем раствора метилового оранжевого концентрации 0,005 г/100 см3, израсходованный на титрование, см3;
0,0217 - титр раствора метилового оранжевого; 0,04 - эмпирический коэффициент;
V1 - объем воды, взятый для анализа, см3;
1000 – коэффициент, учитывающий расчет на 1 дм3.
Задание 5 Рассчитать количество кислоты, требующейся для снижения щелочности умягченной воды
Для снижения щелочности умягченной воды применяются соляная или уксусная кислоты, как химически чистые, так и технические.
Расчет необходимого количества кислот для окисления щелочности производится лабораторией.
Пример 1. Щелочность воды составляет 7 см3 раствора соляной кислоты концентрации 0,1 моль/дм3на 100 см3 воды. Определить количество соляной кислоты, требующееся для доведения щелочности 1000 дал воды до 6 см3 раствора соляной кислоты на 100 см3 воды.
В 1 дм3 раствора содержится 3,64 г соляной кислоты, в 100 дм3 - 364 г.
В концентрированной соляной кислоте плотностью 1,19 г/мл содержится кислоты 39,11%, следовательно, концентрированной соляной кислоты требуется 364 ·100 / 39,11 = 930,7 г или 930,7/1,19 = 782,1 см3.
Пример 2. Щелочность воды составляет 7,5 см3 раствора НСl концентрации 0,1 моль/дм3 на 100 см3. Определить количество уксусной кислоты, требующееся для доведения щелочности 1000 дал воды до 6 см3 раствора соляной кислоты концентрации 0,1 моль/дм3, необходимой на нейтрализацию 100 см3 воды.
Для снижения щелочности воды на 1,5 см3 (7,5-6,0) требуется добавить 1,5 см3 раствора уксусной кислоты концентрации 0,1 моль/дм3 на 100 см3 воды, что соответствует 150 дм3 раствора уксусной кислоты на 1000 дал воды.
В 1 дм3 раствора уксусной кислоты концентрации 0,1 моль/дм3 содержится 6 г уксусной кислоты, а в 150 дм3 - 900 г кислоты. При применении раствора уксусной кислоты с массовой долей 80% требуется добавить 900·100/80·1,07 = 1,05 дм3 раствора кислоты на 1000 дал воды.
Задание 6 Сделать выводы по проделанной работе, ответить на контрольные вопросы
Вопросы для контроля:
1. Назовите микробиологические и токсикологические показатели питьевой воды.
2. Назовите требования к воде, используемой для приготовления ликероводочных изделий.
3. Расскажите методику отбора проб воды и схему контроля качества воды, поступающей на производство ликероводочных изделий.
4. Перечислите органолептические показатели качества воды, расскажите методику их определения.
5. Что понимают под щелочностью воды?
6. Что характеризует показатель окисляемости воды? Как он определяется?
7. Как определить содержание активного остаточного хлора в воде?
8. Что такое жесткость воды и чем она определяется? Каково влияние жесткости воды на качество ликероводочных изделий?
9. Расскажите о водоподготовке на ликероводочных предприятиях.
Лабораторная работа №3
АНАЛИЗ ИНГРЕДИЕНТОВ
Цель работы: изучить требования, предъявляемые к показателям качества сахара-песка, сахара-рафинада, натурального меда; освоить органолептические и физико-химические методы их анализа.
Аппаратура и реактивы:
- сушильный шкаф СЭШ-3М с набором металлических бюкс;
- эксикатор, тигельные щипцы, стеклянные палочки;
- весы аналитические;
- поляриметр СУ-3;
- водяная баня;
- рефрактометр УРЛ-1;
- термометр;
- воронки, бумажный фильтр;
- дистиллированная вода;
