Определение молярной массы химического эквивалента металла
Цель работы– ознакомление с понятиями химический эквивалент (Э), молярная масса химического эквивалента М (Э), фактор эквивалентности (f), количество вещества химического эквивалента (n(Э)), объем молярной массы химического эквивалента (V(Э); расчет молярной массы химического эквивалента металла по закону эквивалентов.
Предлагается определитьмолярную массу химического эквивалента металла методом, основанным на измерении объема выделившегося газа при взаимодействии металла с кислотой. Этот метод применим только для металлов, стоящих в ряду стандартных электродных потенциалов левее водорода, которые способны вытеснять водород из кислот– неокислителей (HCl, H2SO4 разб.).
Для выполнения настоящей лабораторной работы следует провести химическую реакцию магния с избытком разбавленной серной кислоты:
Mg + H2SO4 = MgSO4 + H2↑ +Q
и определить объем выделившегося водорода с помощью прибора, изображенного на рис. 2.1.
Прибор для определения химического эквивалента металла (эвдиометр) состоит из V-образной бюретки 1 и уравнительного сосуда 2, соединенных резиновой трубкой; стеклянного тройника 3, левое колено которого снабжено запорным краном. На нижнее колено тройника надета пробка 4, плотно закрывающая бюретку; к правому колену тройника присоединяется пробирка Оствальда 5, которая является реакционным сосудом.
Бюретка и уравнительный сосуд эвдиометра заполнены подкрашенной дистиллированной водой. Объем выделившегося водорода определяют по равен разности уравней воды в бюретке 1.
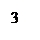 |

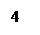
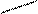
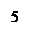


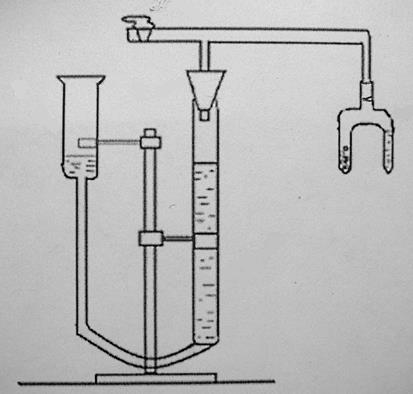
Рис.2.1. Эвдиометр: 1-бюретка, 2-уравнительный сосуд, 3-тройник, 4-пробка, 5- пробирка Оствальда
Последовательность проведения:
1) поместите навеску металла (0,03 г) в левое колено пробирки Оствальда;
2) в правое колено с помощью специальной воронки налейте 10-12мл 1н раствора серной кислоты H2SO4;
3) присоедините пробирку Оствальда к тройнику;
4) установите уровень воды в бюретке 1 на отметке «0» с помощью уравнительного сосуда 2, поднимая или опуская его по вертикали при открытом кране тройника;
5) закройте кран и испытайте эвдиометр на герметичность:
-опустите уравнительный сосуд 2 так, чтобы уровень воды в нем был ниже уровня воды в бюретке 1, и в таком положении укрепите его (при этом уровень воды в бюретке 1 незначительно понизится);
-если через 1-2 мин дальнейшего понижения уровня воды наблюдаться не будет, прибор можно считать герметичным;
6) после испытания прибора на герметичность наклоните пробирку Оствальда таким образом, чтобы серная кислота перелилась в колено, где находится металл;
7) выделяющийся водород вытесняет воду из бюретки и после прекращения выделения газа подождите некоторое время, чтобы газ в пробирке принял температуру окружающего воздуха (реакция экзотермическая);
8) приведите воду в бюретке 1 и уравнительном сосуде 2 к одному уровню;
9) по делениям на бюретке определите объем выделившегося газа - водорода ( в мл).
Обработка результатов и расчеты:
1) результаты наблюдений: показания анероида (температура и давление, объем выделившегося газа и др. - запишите в таблицу 2.1.
Таблица 2.1
| Масса магния, г | Условия опыта | Объем вытесненного водорода, мл | ||
| Температура, Сº | Атмосферное давление, мм рт.ст. | Давление во- дяного пара, мм рт.ст. | ||
| m | t | Patm | h* | V |
*h найдите по таблице 2.2.
Таблица 2.2
| t, Сº | ||||||||
| Давление, мм. рт.ст. | 17,5 | 18,7 | 19,8 | 21,1 | 22,4 | 23,8 | 25,2 | 26,7 |
2) рассчитайте теоретическую молярную массу химического эквивалента магния по формуле: М(Этеор (Mg))=МMg*f , где МMg – молярная масса магния, г; f - фактор эквивалентности магния, равный ½.
3) определите практическую молярную массу химического эквивалента магния по закону эквивалентов (2.20):
М(ЭМg) = m(Mg) . V(ЭH2)/ V0(H2)
где m(Mg)- масса навески магния, г;
MЭ(H2)- молярная масса химического эквивалента водорода, л;
VЭ(H2)- объем молярной массы химического эквивалента водорода, л;
V0(H2)- объем выделившегося водорода, приведенный к нормальным условиям, л.
4) приведите объем выделившегося водорода к нормальным условиям по уравнению объединенного газового закона (2.12);
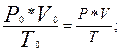
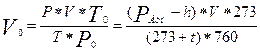
5) определите относительную погрешность эксперимента ( в %) :
П = М(ЭМg)теор. - М(ЭМg)оп. * 100%
М(ЭМg)теор.
Лабораторная работа №3
