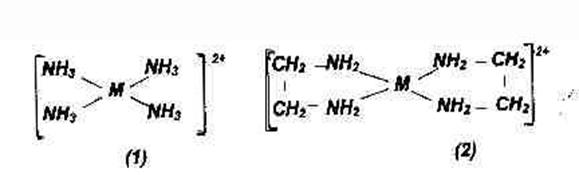
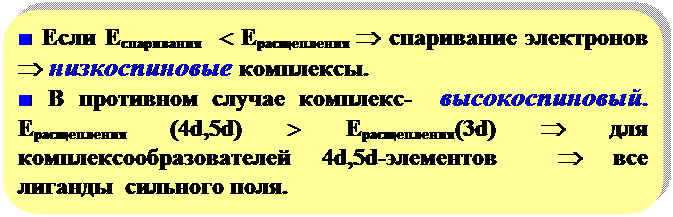
Высокоспиновые комплексы менее прочные, чем низкоспиновые.
И 6 – координационные числа.
 | ||
 |
 |



Используют несколько квантово-механических подходов:
· метод ВС,
· теория поля лигандов
· метод МО.
 |

Между комплексообразователем и лигандами -ковалентные связи, образованные по донорно-акцепторному механизму.
 донор – лиганд (поставщик пары электронов ↑↓) акцептор– комплексообразователь(наличие свободных АО)
донор – лиганд (поставщик пары электронов ↑↓) акцептор– комплексообразователь(наличие свободных АО)

Атом Аl (р-элемент) … 3s23р1
Комплексообразователь Al3+:



 3s03p0
3s03p0
 |  |  | |||||
 | |||||||
 :Br- :Br-:Br- :Br-
:Br- :Br-:Br- :Br-
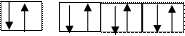 |
Sp3-гибридизация орбиталей.
Строение комплексного иона - тетраэдр

| |||
 |
|
в противном случае - лиганд слабого поля.

Для 3d-элементов - (в порядке возрастания силы поля):
|
Однако границы между сильным и слабым полями лигандов провести сложно, например:
[MnF6]2- лиганд F- - слабое поле,
NiF6]2- лиганд F- - сильное поле.

Атом Fe (d -элемент) … 3 d 64s2
Комплексообразователь Fe3+: 3d 54s0
Лиганды CN- - лиганды сильного поля,
|

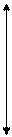


Fe+3
D 4s 4p
d2sp3-гибридизация орбиталей
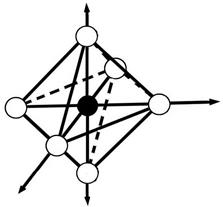
структура комплекса - октаэдр
 | |||
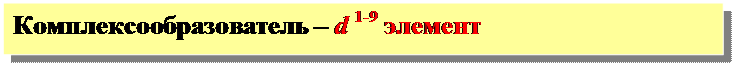 |
· Лиганды располагаются вокруг комплексообразователя так, чтобы силы притяжения были максимальны, а силы отталкивания минимальны.
· Лиганды влияют на энергетическое состояние d-электронов комплексообразователя.
В отсутствии внешнего электростатического поля все d-орбитали - вырожденные.

D - зависит от к.ч., природы лигандов и комплексообразователя (учебник, стр.78)
плоский квадрат
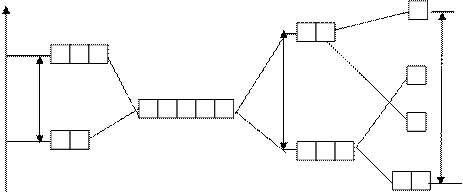 |
октаэдр
тетраэдр
de dg
Dтетр Dокт Dквадр.пл.
dg (n-1)d-орбитали de
свободного иона
комплексообразователя
 | |||
 |
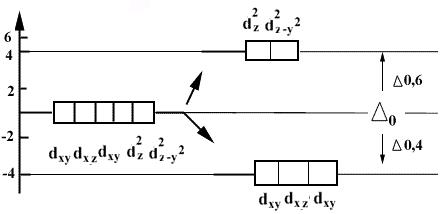 |
Распределение электронов на (n-1)d-орбиталях:
(зависит от силы поля лиганда)
 |
● В образовании химической связи участвуют :
N-1)dg-, ns-, np- и nd- орбитали.

■ комплексообразовательСо2+: 3d 74s0
К.ч. 6 Þ октаэдрическое расщепление
■ центральный атом – 3d – элемент Þ сила поля лиганда по спектрохимическому ряду:
Н2О – лиганд среднего поля, а для Со2+ (низшая степень окисления) он относится к слабым.
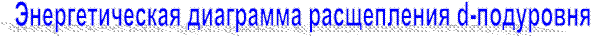
:н2о:н2о:н2о:н2:н2о:н2о









 Е
Е

3dg 4s 4p 4d
 |


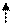
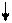
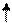
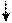
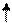
 3de
3de
Sp3d2-гибридизация
● структура комплекса [Со(Н2О)6]2+ - октаэдр
● комплекс – высокоспиновый,
Внешнеорбитальный (т.к. взаимодействует внешний d- подуровень).
Высокоспиновые комплексы менее прочные, чем низкоспиновые.

 |
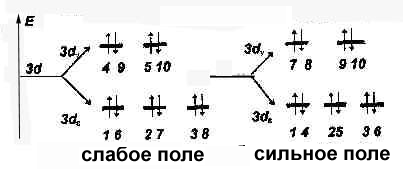
· Если на (n-1)de,g - орбиталях имеются неспаренные электроны, комплекс –
парамагнетик (слабые магнитные свойства)
· Если на (n-1)dg,e – орбиталях нет неспаренных электронов, комплекс -диамагнетик ( нет магнитных свойств)
Þ [Со(Н2О)6]2+ - парамагнетик

■ комплексообразователь Pt4+: 5d 66s0