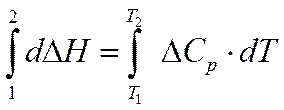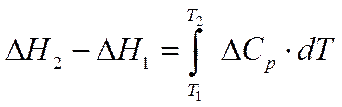Яғни мұндағы мен химиялық реакцияның жылу эффектісінің температуралық коэффициенті
Жылусыйымдылықтың өзгерісі мынаған тең:
Мұндағы vi- осы заттарға сәйкес жылу сыйымдылықтарының стехиометриялық коэффиценттері. Егер
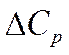 >0,
>0, 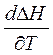 >0 болса, онда Т↑ , ΔН↑
>0 болса, онда Т↑ , ΔН↑
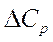 <0,
<0, 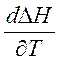 <0 болса, онда Т↑ , ΔН↓
<0 болса, онда Т↑ , ΔН↓
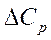 =0,
=0, 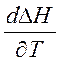 =0 болса, онда ΔН≠f(T)
=0 болса, онда ΔН≠f(T)
Гесс заңына негізделіп белгісіз реакциялардың, тіпті іс жүзінде жүрмейтін реакциялардың жылу эффектілерін есептеуге болады. Ол үшін келесі әдістерді пайдалануға болады:
а. Химиялық реакцияларды үйлестіру арқылы керекті реакцияның жылу эффектісін табу әдісі. Мысал қарастырайық. Берілген реакциялардың жылу эффектісі берілген дейік:
1. С (графит) + О2(газ) = СО2 (газ) + ΔН1
2. СО(газ) +1/2 О2 = СО2 + ΔН2
Осы екі реакция арқылы
. С (графит) + 1/2О2(газ) = СО (газ) реакциясының жылу эффектісін табуға болады, ол үшін бірінші теңдеуден екінші теңдеуді алып тастаймыз: . С (графит) + О2(газ) - СО(газ) - 1/2 О2 = СО2 - СО2
С (графит) + 1/2О2(газ) - СО(газ) = 0
С (графит) + 1/2О2(газ) = СО(газ) Сонда бұл реакцияның жылу эффектісі ΔН3 =ΔН1 – ΔН2
ә. Реакцияға қатысқан заттардың жану жылуларының көмегімен реакцияның жылу эффектісін табу әдісі. Гесс заңынан шығатын салдар бойынша реакцияның жылу эффектісі реакцияға қатысатын заттардың жану жылуларының алгебралық қосындысына тең. Заттың жану жылуы деп осы заттың оттегімен әрекеттесіпжоғарғы оксидтер бергендегі реакцияның жылуы. Жану жылуы 1 моль затқа келтіріледі. Реакцияның жылу эффектісі реакцияға түскен заттардың ж/е реакция өнімдерінің жану жылуларының қосындысының айырымына тең.: ΔHro = ΣΔ HС0,298, (түскен зат) – ΣΔНС0,298, (шыққын зат). Мысал қарастырайық: ацителеннен 298К де бензолдың түзілу реакциясының жылу эффектісін табу керек. Ол үшін ацителеннің ж/е бензолдың жану жылуларын білу керек 3С2Н2 (газ) = С6Н6 (сұйық) Осы жерде ΔНr0,298, = 3 ΔНС0,298, (С2Н2) - ΔНС0,298 (С6Н6)
б. Реакцияға қатысатын заттардың түзілу жылуларының көмегімен реакцияның жылу эффектісін табу әдісі. Гесс заңынан шығатын тағы да бір салдар бойынша реакцияның жылу эффектісі реакцияға қатысатын заттардың түзілу жылуларының алгебралық қосындысына тең. Заттың түзілу жылуы деп жай заттардан 1 моль зат түзілгендегі жылуды аламыз. Анықтамалықтарда келтірілген заттардың түзілу жылулары стандартты жағдайларда алынады. Стандартты жағдайда ол ΔНf0,298 деп белгіленеді. . Реакцияның жылу эффектісі реакция өнімдерінің ж/е реакцияға түскен заттардың жану жылуларының қосындысының айырымына тең.: ΔHro = ΣΔ Hf0,298, (шыққын зат) – ΣΔНС0,298, (түскен зат). Мысал қарастырайық С2Н4(газ) + Н2О (газ) =С2Н5ОН (газ), Осыдан этанолдың түзілу реакциясының жылу эффектісі ΔНr0,298, = ΔНf0,298, (С2Н5ОН) – {ΔНf0,298 (С2Н4) + ΔНf0,298 (Н2О) }
Кирхгоф заңы:процесстің жылу эффектісі нің температуралық коэффициенті процесс нәтижесінде жүйенің жылусыйымдылығының өзгеруіне тең.
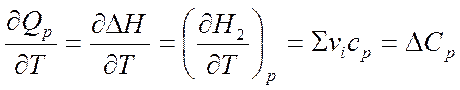 - Кирхгоф теңдеуі. Ол Т1 температурамен Т2 температура аралығында жылу эффектісінің температураға байланысын көрсетеді. Интегралдау әдісі бойынша:
- Кирхгоф теңдеуі. Ол Т1 температурамен Т2 температура аралығында жылу эффектісінің температураға байланысын көрсетеді. Интегралдау әдісі бойынша: