Тема: виділення хлорофілу з зеленого листя
Лабораторна робота №2
Тема: Ідентифікація амінокислот методом тонкошарової хроматографії.
Мета: Оволодіти технікою тонкошарової хроматографії (ТШХ).
Завдання: Методом ТШХ ідентифікувати невідому речовину.
Хроматографічні методи
Хроматографічний метод аналізу відкритий російським вченим Цвітом М.С. Це фізико-хімічний метод аналізу, який використовують для розділення і аналізу складних сумішей та визначення властивостей індивідуальних хімічних сполук. Метод дозволяє проводити як якісний так і кількісний аналіз об’єктів, вивчати фізико-хімічні властивості сполук.
Широке розповсюдження хроматографічні методи отримали завдяки їх універсальності (можливо використовувати їх для розділення та визначення твердих, рідких та газоподібних органічних та неорганічних речовин в широкому інтервалі концентрацій), селективності та ефективності (дозволяє проводити розділення сполук із близькими властивостями), простоті експерименту, експресності, можливості автоматизації (що особливо важливо при контролі та регулюванні технологічних процесів), а також використанні їх з іншими фізико-хімічними методами.
Хроматографічні методи розділення основані на сорбційних процесах. Отже хроматографія – це динамічний сорбційний спосіб розділення сумішей, який оснований на розподілі речовин між двома фазами, одна з яких рухома, а інша нерухома та пов’язаний із багаторазовим повторенням сорбційних та десоорбційних процесів.
При класифікації різних хроматографічних методів враховують природу рухомої та нерухомої фаз, механізм взаємодії між фазами і речовинами, що розділяються та техніку експерименту. Так за домінуючим механізмом розділення хроматографію класифікують на адсорбційну, розподільчу, іонообмінну, осадову, дифузійно-молекулярну. За типами стаціонарних та рухомих фаз хроматографію класифікують на газо-рідинну, газо-твердофазну, розподільчу, паперову, тонкошарову, гель-хроматографію та інші. За методом проходження рухомої фази хроматографію класифікують на три типи: висхідна, низхідна та радіальна.
Основні поняття хроматографії.
Адсорбція – розчинених чи газоподібних речовин поверхнею твердого тіла або рідини. При цьому відбувається концентрування речовини (адсорбату, адсорбтиву) з об’єму фаз на поверхні розділу між ними.
Адсорбенти – високодисперсні штучні чи природні тіла із великою зовнішньою (непористі) або внутрішньою (пористі) поверхнею, на якій проходить адсорбція речовин із газів чи розчинів, які із нею стикаються. Органічні адсорбенти, які найчастіше використовують в фармацевтичні хімії – це сахароза, інулін, молочний цукор, целюлоза, крохмаль. Неорганічні адсорбенти – алюмінію оксид, кальцію карбонат, кальцію оксид, силікагель, цинку або магнію оксид, активоване вугілля, деякі природні мінерали, різні сорти глини.
Будь-який сорбційний процес характеризується константою (коефіцієнтом) розподілення (Rf), який являє собою відношення рівноважної концентрації речовини в одній визначуваній формі у нерухомій фазі (с1) до концентрації речовини у тій же формі в рухомій фазі (с2).
Rf= с1/с2
Коефіцієнт розподілення залежить від природи визначуваної речовини, природи рухомої та нерухомої фази, температури, рН, концентрації та іонної сили розчину.
Найпростішими за технікою виконання є паперова та тонкошарова хроматографії, тому в фармацевтичній хімії та біохімії ці методи використовуються найчастіше.
Розподілення в тонкошаровій хроматографії проходить у шарі тонкодисперсного адсорбенту, який нанесено на скляну пластинку або алюмінієву фольгу.
Адсорбенти в тонкошаровій хроматографії – це алюмінію оксид, силікагель, діатоміти або подрібнена целюлоза.
Для отримання тонкошарової хроматограми пробу наносять на один кінець пластини, вносять у закритий посуд (хроматографічну камеру) та занурюють її у розчинник. В цьому випадку потік розчинника рухається знизу догори і таким чином можна отримати висхідну хроматограму. Після закінчення хроматографування пластину виймають висушують та визначають положення різних компонентів. Для цієї цілі найчастіше використовують реагенти (проявники), які утворюють забарвлені сполуки в присутності визначуваних речовин (функціональних груп). Так, розчин нінгідрину забарвлює на хроматограмі аміни або амінокислоти.
В тонкошаровій хроматографії коефіцієнт розподілення знаходять за формулою:
Rf= h1/h2
де h1 – відстань від лінії старту визначуваної речовини до загальної відстані проходження цієї речовини, мм
h2 – відстань проходження розчинника від лінії старту до лінії фронту, мм
Для ідентифікації речовин дуже часто використовують розчин стандартного зразку речовину–свідка (СЗРС) – це розчин речовини, яка повинна знаходитися у визначуваному розчині.
Порядок виконання роботи
Методика визначення:1 мл розчину невідомої речовини переносять в мірну колбу місткістю 25 мл, додають 0,5 мл розчину хлоридної кислоти, доводять об'єм розчину водою до мітки і перемішують. На лінію старту пластинки “Silufol” або “Sorbfil” дозатором наносять по 20 мкл (30 мкг) випробуваного розчину і розчину стандартних зразків речовин-свідків кислоти аспарагінової та гліцину. Пластинку з нанесеними пробами висушують на повітрі впродовж 10 хвилин, вміщують в хроматографічну камеру із сумішшю розчинників: спирт н-бутиловый - спирт етиловий - кислота оцтова - вода (3:7:1:3) і хроматографують висхідним методом. Коли фронт розчинників пройде 10 см, пластину виймають з камери, висушують на повітрі впродовж 10 хвилин, обприскують розчином нінгідрину і витримують в сушильній шафі при температурі від 100 до 1050С 2 хвилини.
На хроматограмі досліджуваного розчину повинна виявлятися пляма або плями на рівні плям СЗРС кислоти аспарагінової та гліцину з коефіцієнтом розподілу Rf = 0,4-0,8. Не повинні бути присутніми сторонні плями з Rf менше за 0,20. Допустимі плями на рівні старту.
Примітки:
1. Приготування розчину СЗРС кислоти аспарагінової. 0,025 г кислоти аспарагінової вміщують в склянку, додають 2 мл розчину кислоти хлоридної (1 мл концентрованої хлоридної кислоти розводять водою до 100 мл) і 10 мл води, нагрівають на електроплитці до розчинення і охолоджують. Отриманий розчин кількісно переносять в мірну колбу місткістю 50 мл, доводять водою до мітки і перемішують.
2. Приготування розчину нінгідрину. 0,2 г нінгідрину вміщують в мірну колбу місткістю 100 мл і розчиняють при перемішуванні в 50 мл ацетону, доводять об'єм розчину ацетоном до мітки і перемішують.
Контрольні питання:
1. Суть хроматографічних методів, їх класифікація, межі використання.
2. Дайте поняття адсорбенту, рухомої фази, коефіцієнту розподілу.
3. Техніка виконання тонкошарової хроматографії.
Лабораторна робота №3
Тема: виділення хлорофілу з зеленого листя
Мета: оволодіти технікою хроматографії на колонці.
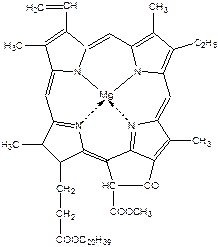
Хлорофіли – це магнійзаміщені похідні порфірину – природні пігменти, які надають зеленого забарвлення багатьом рослинам, овочам і плодам.
Хлорофіл - зелений пігмент рослин - складається із суміші декількох пігментів: синьо-зеленого хлорофілу a і жовто-зеленого хлорофілу b, які містяться у співвідношенні 3:1. При пропусканні розчину хлорофілу через колонку відбувається сорбція й поділ пігментів відповідно до їх вибіркової сорбуємості.
Хроматографічне розділення пігментів зеленого листя рослин складається з наступних етапів: 1) екстрагування пігментів з рослинного матеріалу; 2) утворення хроматограми; 3) одержання розчинів хлорофілу-a, хлорофілу-b і каротиноідів.
При підготовці розчину для хроматографування пігменти вилучають із рослинного матеріалу полярним розчинником, а потім розчиняють у суміші неполярних розчинників. Отриманий розчин хроматографують. Первинну хроматограму промивають полярним розчинником й у розчині, що витікає, збирають окремі фракції пігментів.
Порядок виконання роботи
Методика визначення. Для аналізу беруть наважку рослинного матеріалу зі свіжих зелених (3 - 5 г) або сухих листів (1 г). Свіжий рослинний матеріал поміщають у порцелянову ступку й ретельно розтирають. Для кращого розтирання додають дрібне скло або кварцовий пісок. Якщо для досліду взятий сухий матеріал, то його подрібнюють у ступці.
В отриману рослинну масу додають 15 мл суміші бензину й бензолу (9:1) і 10 мл ацетону, знову розтирають і перемішую. Суміш переносять на скляний фільтр № 2. Ступку очищають, обполіскуючи її чистим ацетоном. Промивну рідину також переносять на фільтр №2. Екстракт пігментів відфільтровують. Для більш повного відділення пігментів масу, що залишилася на фільтрі, промивають декількома порціями ацетону (по 5 мл) доти, поки фільтрат, що витікає, не стане безбарвним, тобто не буде містити пігментів.
Отриманий після фільтрування екстракт пігментів переносять із приймача в ділильну лійку, відокремлюють ацетон шляхом обережного введення в лійку 50 мл дистильованої води. Рідину в ділильній лійці злегка збовтують. Варто уникати сильного збовтування, тому що може утворитися стійка емульсія.
Після того як відбудеться розшарування двох рідких фаз, що не змішуються, нижню фазу (вода - ацетон) зливають. У ділильну лійку обережно вводять нову порцію води (50 мл). Після розшарування рідин водну фазу зливають. Операцію відмивання ацетону проводять 10 разів. Бензино-бензольний екстракт просушують після видалення всіх водорозчинних речовин. Для цього екстракт переносять у колбу ємністю 50 мл, у яку додають 2 - 3 г прожареного сульфату натрію. Екстракт відфільтровують через скляний або паперовий фільтр.
Хроматографування проводять у скляній колонці розміром 20´1 см. Унизу колонки поміщають ватний тампон і вносять невеликими порціями сорбент CaCO3 або цукровий порошок. Ущільнення сорбенту проводять постукуванням трубки об тверду поверхню.
У підготовлену колонку вводять порцію (5 мл) екстракту. Отриману первинну хроматограму промивають сумішшю бензину й бензолу (9:1). При промиванні колонки відбувається поділ зон, угорі колонки утвориться зелена зона b-хлорофілу, потім синьо-зелена a-хлорофілу, трохи нижче розташовується зона жовтого кольору (каротиноіди).
При подальшому промиванні колонки розчинником у фільтрат переводяться спочатку жовті пігменти (каротиноіди), потім a-хлорофіл й b-хлорофіл. Фракції збирають в окремі приймачі.
