Тема 2.4. Хімічна кінетика
План
- Кінетика. Поняття про швидкість реакції.
- Фактори, які впливають на швидкість реакції
2.1. Концентрація реагуючих речовин.**
2.2. Температура та природа реагуючих речовин.*
2.3. Наявність каталізаторів.*
1. З курсу хімії ви вже знаєте, що всі реакції відбуваються з різними швидкостями. Деякі з них повністю закінчуються за малі частки секунди, інші тривають хвилини, години, дні; відомі реакції, що потребують для свого перебігу кілька років, десятиріч і ще більших відрізків часу. Крім того, та сама реакція може в одних умовах, наприклад, при підвищених умовах відбуватися швидко, а в інших, наприклад, під час охолодження, − повільно.
Знання швидкостей хімічних реакцій має дуже велике наукове і практичне значення. Наприклад, у хімічній промисловості при виготовленні тієї чи іншої речовини від швидкості реакції залежать розміри і продуктивність апаратури, кількість виготовленого продукту.
Розділ хімії, що вивчає швидкість хімічних реакцій, називається хімічною кінетикою.
Швидкістю гомогенної реакції називається: 1) кількість речовини, що вступає в реакцію або утворюється під час реакції за одиницю часу в одиниці об’єму системи
2) Швидкістю реакції в гомогенній системі називається зміна концентрації будь-якої з речовин, що вступають у реакцію або утворюються під час реакції, що відбувається за одиницю часу.
 або
або  ,
,
де ΔС – зміна концентрації; Δn – зміна кількості речовини; Δt – зміна часу; V – об’єм системи.
Швидкістю гетерогенної реакції називається кількість речовини, що вступає в реакцію або утворюється під час реакції за одиницю часу на одиниці поверхні фази.
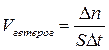 , де S – площа поверхні фази, на якій відбувається реакція
, де S – площа поверхні фази, на якій відбувається реакція
2. Фактори, що впливають на швидкість реакції:
· Природа реагуючих речовин;
· Концентрація речовин;
· Температура;
· Наявність у системі каталізаторів
2.1. Необхідною умовою, щоб між частинками вихідних речовин відбулася хімічна взаємодія, є їхнє зіткнення одна з одною. Тому швидкість реакції пропорційна числу зіткнень, яких зазнають молекули реагуючих речовин.
Число зіткнень тим більше, чим вища концентрація кожної з вихідних речовин, або те саме, чим більший добуток концентрацій реагуючих речовин. Так, швидкість реакції А + В → С пропорційна добутку концентрації речовини А на концентрацію речовини В. Позначаючи концентрації речовин А і В відповідно через [А] і [В], можна написати:
υ = k[А][В], де
k – коефіцієнт пропорційності, що називається константою швидкості реакції.
Аналогічно, для реакції 2А + В → С можна написати υ = k[А][А][В] = k[А]2[В].
Викладені міркування підтверджуються законом діючих мас (закон Гульдберга-Вааге): При сталій температурі швидкість хімічної реакції пропорційна добуткові концентрацій реагуючих речовин, причому кожна концентрація входить у добуток в степені, що дорівнює коефіцієнту, який стоїть перед формулою речовини в рівнянні реакції.
Щоб дістати рівняння закону діючих мас, напишемо рівняння хімічної реакції в загальному вигляді: aA + bB + …→ …
Тоді за законом діючих мас можна записати у формі:
υ = k[А]a[В]b…
У випадку гетерогенних реакцій у рівняння закону діючих мас входять концентрації тільки тих речовин, які перебувають в газовій фазі або в розчині. Концентрація речовини, що перебуває в твердій фазі, звичайно є сталою величиною і тому входить у константу швидкості.
Величина константи швидкості залежить від природи реагуючих речовин, температури і наявності каталізаторів, але не залежить від концентрацій речовин.
2.2. Якщо скористатися результатами підрахунків, то виявиться, що число зіткнень між молекулами речовин за звичайних умов таке велике, що всі реакції мають відбуватися практично миттєво. Але не всі реакції закінчуються швидко. Цю суперечність можна пояснити, припустивши, що не всяке зіткнення речовин приводить до утворення продукту реакції. Щоб сталася реакція, треба спочатку розірвати або ослабити зв’язки між атомами в молекулах вихідних речовин, а на це потрібно затратити певну енергію.
З підвищенням температури число активних молекул зростає. Звідси виходить, що і швидкість хімічної реакції має збільшуватися з підвищенням температури.
Зростання швидкості реакції із зростанням температури прийнято характеризувати температурним коефіцієнтом швидкості реакції – числом, що показує, у скільки разів зростає швидкість певної реакції при підвищенні температури системи на 10 градусів. Температурний коефіцієнт різних реакцій різний.
Правилом Вант-Гоффа:
При підвищенні температури на кожні 10°С швидкість реакції зростає в 2-4 рази.
Математичний вираз правила Вант-Гоффа:

γ- температурний коефіцієнт; Т1 і Т2 – початкова і кінцева температури
2.3. Речовини, що не витрачаються в результаті проходження реакції, але не впливають на її швидкість, називаються каталізаторами. Явище зміни швидкості реакції під дією каталізаторів називається каталізом.
У більшості випадків дія каталізаторів пояснюється тим, що він знижує енергію активації реакції. При наявності каталізатора реакція проходить через інші проміжні стадії, при чому ці стадії енергетично більш доступні.
Контрольні запитання:
- Що називається швидкість реакції?
- Назвіть фактори, які впливають на швидкість хімічної реакції.
- У скільки разів збільшиться швидкість реакції при підвищенні температури з 20ºС до 40ºС, якщо температурний коефіцієнт дорівнює 3?
- При охолодженні реакційної суміші з 80ºС до 50ºС швидкість хімічної реакції зменшилась у 27 разів. Визначте температурний коефіцієнт реакції.
- У скільки разів збільшиться швидкість реакції СО(г) + Cl2(г) → COCl2(г), якщо концентрації вихідних речовин збільшити в 2 рази?
Література:
- Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1979. – Гл. VІ, §§ 57-61, с. 170-181.
- Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. І, Гл. 4, §§ 30-32, с. 40-43.
