Теплоты гидратации некоторых ионов
в бесконечно разбавленных растворах при 25 °С [8]
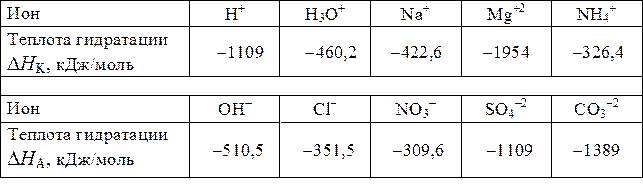
|DHг| Пример 1. Определить теплоту гидратации моля NaCl.
Решение.
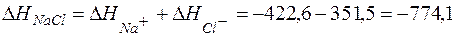 кДж/моль.
кДж/моль.
Теплота гидратации NaCl весьма значительна, что говорит о прочности гидратированных ионов, образующихся в растворе.
Свойства растворов электролитов
Сильные электролиты в растворе диссоциированы (ионизированы) практически полностью. Диссоциация слабых электролитов протекает обратимо и устанавливается равновесие (7.1).
Количественно процесс диссоциации может быть охарактеризован рядом величин: степенью диссоциации a, изотоническим коэффициентом i, константой электролитической диссоциации Kд, эквивалентной электропроводимостью l.
Степень электролитической диссоциации a – это отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества в растворе.
Степень диссоциации a может измеряться в долях единицы или в процентах (%). Если a = 0, диссоциация отсутствует, вещество растворяется в молекулярной форме и является неэлектролитом. Когда a = 1 или a = 100 %, происходит полная диссоциация электролита и растворенное вещество находится только в ионной форме.
Деление электролитов на слабые и сильные проводится по значению a – степени диссоциации для 0,1 н. растворов электролитов при температуре t = 25 °С. Сильные электролиты – вещества, которые в 0,1 н. растворе хорошо проводят электрический ток и диссоциируют больше чем на 30 %. К сильным электролитам относятся хорошо растворимые соли, а также сильные кислоты и основания (табл. 5).
Таблица 5
Примеры электролитов
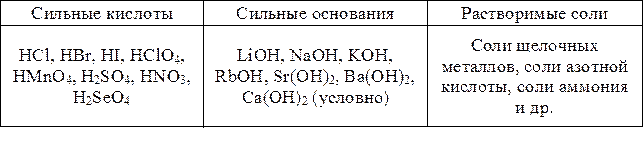
К слабым электролитам относятся кислоты и основания, которые в 0,1 н. растворе плохо проводят электрический ток и диссоциируют менее чем на 3¸5 %. Также к ним относят труднорастворимые соли, для которых низкая электропроводность раствора связана с малой концентрацией соли в растворе (хотя a диссоциации таких солей близка к 1).
Электролиты средней силы характеризуются степенью диссоциации 5¸30 %.
К процессу электролитической диссоциации применим принцип Ле Шателье, позволяющий выявить влияние внешних факторов на состояние равновесия, приводящее к изменению a. Для смещения равновесия в сторону продуктов диссоциации необходимо увеличить массу растворителя.
Теплота гидратации понижается с повышением температуры (вследствие уменьшения координационного числа гидратированных ионов), процесс диссоциации становиться более эндотермичным, поэтому повышение температуры будет смещать равновесие реакции диссоциации (7.1) слева направо. Степень диссоциации слабого электролита в водном растворе будет увеличиваться с повышением температуры.
