Образуется 2,5 молекулы АТФ при окислении молекулы НАДН и 1,5 молекулы АТФ при окислении молекулы ФАДН2.
Образованная в результате окислительного фосфорилирования в митохондриях АТФ обменивается на внемитохондриальную АДФ с помощью специальных белков транслоказ (транслоказы составляют до 6% от всех белков внутренней мембраны митохондрий).
Дыхательный контроль и нарушения клеточного дыхания
Дыхательный контроль – это регуляция скорости переноса электронов по дыхательной цепи отношением АТФ/АДФ. Чем меньше это отношение (преобладает АДФ), тем интенсивнее идет дыхание (это обеспечивает реакцию АДФ + Рн ® АТФ). Это видно по увеличению потребления кислорода митохондриями после добавки АДФ или по усиленному дыханию бегущего человека.
Ингибиторы дыхания
Вещества, прекращающие поток электронов по дыхательной цепи ферментов, называют ингибиторами дыхания.
1. Ингибиторы транспорта электронов от НАДН к коферменту Q: ротенон (инсектицид), барбитураты (амобарбитал, секобарбитал), пирицидин (антибиотик). Предотвращают генерирование протонного градиента в комплексе I. В то же время указанные ингибиторы не нарушают окисление сукцината.
2. Антимицин А тормозит поток электронов от КоQ к цитохрому c, предотвращая синтез АТФ, сопряженный с генерированием протонного градиента в комплексе III. Этот блок можно обойти добавлением аскорбиновой кислоты, которая непосредственно восстанавливает цитохром с.
3. Транспорт электронов может быть блокирован между цитохромоксидазным комплексом и кислородом под действием CN-, N3- и СО. В присутствии этих ингибиторов из-за блокирования тока электронов не происходит фосфорилирования, сопряженного с генерированием протонного градиента в комплексе IV.
4. Олигомицин и дициклогексилкарбодиимид (DCCD) предотвращают поток протонов через АТФ-синтазу.
5. АТФ-АДФ-транслоказа специфически ингибируется очень низкими концентрациями атрактилозида (растительный гликозид) или бонкрековой кислотой (антибиотик). Атрактилозид связывается с транслоказой на цитозольной поверхности мембраны, а бонкрековая кислота – на стороне матрикса. Блокада транслоказы ведет к остановке окислительного фосфорилирования.
Разобщение дыхания и окислительного фосфорирования.Возникает при повышении проницаемости мембраны митохондрий для протонов в любом месте, а не только в канале АТФ-синтазы. При этом не создается электрохимический потенциал и энергия окисления рассеивается в виде тепла. Так действуют ионофоры (2,4-динитрофенол, валиномицин и др.). Они переносят обратно протоны через мембрану, выравнивая градиенты рН и мембранного потенциала. Лекарственные препараты (аминобарбитал), продукты жизнедеятельности микроорганизмов, избыток тироидных гормонов (вызывают накопление ненасыщенных жирных кислот, являющихся ионофорами) и др. приводят к разобщению дыхания и фосфорилирования, обеспечивая гипертермию.
На разобщении дыхания и фосфорилирования базируется терморегуляторная функция тканевого дыхания. Тканевое дыхание, протекающее в митохондриях и не сопровождающееся образованием макроэргов, называют свободным или нефосфорилирующим окислением.
Природным разобщающим агентом является термогенин, протонный канал в митохондриях бурых жировых клеток. Бурый жир обнаружен у новорожденных и животных, впадающих в зимнюю спячку, и служит для теплообразования. При охлаждении организма норадреналин активирует гормонзависимую липазу. Благодаря активному липолизу в организме образуется большое количество свободных жирных кислот, которые распадаются в результате β-окисления и в дыхательной цепи. Так как жирные кислоты одновременно открывают протонный канал термогенина, их распад не зависит от наличия АДФ, т.е. протекает с максимальной скоростью и генерирует энергию в форме тепла.
Гипоэнергетические состояниявозникают при нарушении:
1) поступления субстратов для дегидрирования (на всех этапах от пищи до матрикса митохондрий);
2) поступления О2 в митохондрии (на всех этапах от дыхания, связь с кислорода с гемоглобином, транспорт и пр.);
3) мембран митохондрий, композиции липидного бислоя и ферментативных ансамблей внутренней мембраны митохондрий.
Напомним, что предложено вычислять энергетическое состояние клетки, вычисляя «заполнение» системы АТФ-АДФ-АМФ макроэргами. Если все три компонента представлены АТФ, то система энергетически полностью заполнена и ее энергетический заряд равен 1,0. Если же система представлена только АМФ, то ее энергетический заряд равен 0. Энергетический заряд клетки является важной величиной, определяющей соотношение катаболических и анаболических процессов в ней. В тканях животных важную регуляторную роль выполняет величина отношения АТФ/АДФ.
В сутки человек потребляет в среднем 27 моль кислорода. Основное его количество (примерно 25 моль) используется в митохондриях в ЦПЭ. Следовательно, ежесуточно синтезируется 125 моль АТФ, или 62 кг (при расчете использован коэффициент Р/О = 2,5, т.е. среднее значение коэффициента фосфорилирования). Масса всей АТФ, содержащейся в организме, составляет примерно 20-30 г. Следовательно, каждая молекула АТФ за сутки 2500 раз проходит процесс гидролиза и синтеза.
Оксигеназный путь.Оксигеназы – это ферменты, катализирующие включение атома или молекулы кислорода в субстрат окисления. Служат для синтеза и деградации различных метаболитов. Оксигеназы представлены двумя типами ферментов.
Монооксигеназы (оксигеназы со смешанной функцией, гидроксилазы, микросомальное окисление) катализируют присоединение одного атома кислорода к молекуле субстрата. При этом возникает гидроксильная группа, повышается растворимость вещества и проявляются новые фармакологические свойства. Для работы монооксигеназной системы необходимы следующие основные компоненты: неполярный субстрат R-CH3; кислород О=О; дополнительный субстрат НАДФН+Н+ – донор атомов водорода; цитохром Р-450.
Связанный с СО цитохром Р-450 имеет максимум поглощения при 450 нм (отсюда название – цит Р-450). Выполняет две функции: 1) связывание субстрата гидроксилирования; 2) на цит Р-450 происходит активация молекулярного кислорода.
Монооксигеназный путь окисления локализован в мембранах эндоплазматического ретикулума (после разрушения клеток эти мембраны замыкаются в микросферы – микросомы). Микросомальное окисление представляет короткую цепь, включающую НАДФ, ФАД, Fe2S2 - белки (адренодоксин), цитохромы Р-450, b5. В общем виде микросомальное окисление неполярных ксенобиотиков (лекарств) осуществляется с помощью гидроксилазного цикла.
Процесс микросомального гидроксилирования можно представить следующим уравнением:
RСH3+НАДФН+Н+ + О2 ® RСН2ОН + НАДФ+ + Н2О,
где RСH3 — окисляемый субстрат.
Следует отметить, что окисление органических соединений в микросомальных монооксигеназных реакциях, в отличие от реакций митохондриального окисления, как правило, не решает никаких энергетических задач, а выполняет защитную (детоксикационную) и пластическую функции. Окисленные продукты могут быть использованы в качестве пластического материала или сразу же удаляются из организма.
Весь каталитический процесс микросомального окисления может быть разбит на 6 основных стадий.
1. Вещество, подвергающееся биотрансформации (RСH3) на этой стадии взаимодействует с окисленной формой цитохрома Р-450 (Fе3+) с образованием фермент-субстратного комплекса RСH3 - Р-450 (Fe3+). Трехвалентное железо не может связывать кислород.
2. НАДФН+Н+ передает 2 атома водорода на ФАД. ФАД восстанавливается в ФАДН2.
3. С помощью FeS белков происходит разделение потоков протонов и электронов. 1-й электрон связывается с комплексом RСH3 – P-450 (Fe3+) и переводит его в RСH3 – Р-450 (Fe2+).
4. Восстановленный фермент-субстратный комплекс взаимодействует с молекулярным кислородом с образованием тройного оксигенированного фермент-субстратного комплекса RСH3-Р-450 (Fe2+) - О2.
5. Происходит восстановление кислорода за счет второго электрона и превращение его в свободный радикал. RСH3-Р-450 (Fe2+) - О2·¯.
6. Стадия характеризуется внутримолекулярными превращениями восстановленного тройного комплекса и его распадом с высвобождением воды и гидроксилированного субстрата (RСН2OH). При этом цитохром Р-450 переходит в исходную форму, готовую к взаимодействию со следующей молекулой субстрата.
В митохондриях содержится монооксигеназная система, локализованная на внутренней стороне внутренней мембраны митохондрий, которая выполняет биосинтетическую функцию, т.е. введение ОН-групп при биосинтезе стероидных гормонов (кора надпочечников, семенники, яичники, плацента), холестерола, при образовании кальцитриола (витамин Д3) из 25-гидроксихолекальциферола в почках и при синтезе желчных кислот в печени.
Свободно-радикальное окисление.Под свободными радикалами понимают молекулу или ее часть, имеющую неспаренный электрон на молекулярной или на внешней атомной орбите. Появление неспаренного электрона – реализация у молекулы свободной валентности. Свободные радикалы реакционноактивны и вступают в химические реакции для приобретения недостающего электрона. Полное восстановление О2 до Н2О требует присоединения 4 электронов: О2 + 4е- + 4Н+ ® 2Н2О.
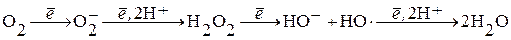
При неполном восстановлении (т.е. присоединении 1, 2 или 3е-) образуются свободно-радикальные формы кислорода: О2×` – супероксидный анион; НО× – гидроксильный радикал (RO∙ - алкоксильный радикал), ∙О2Н – супероксидный радикал.
К реактивным формам кислорода относят оксид азота (NO∙), пероксинитрит (ONOO-) и озон. По L.Flohe и H.Budde (2006) в клеточной биологии под свободными радикалами понимают малые высоко реактивные О-, N-, S- и C-центровые радикалы, которые участвуют в оксидативном или нитросативном стрессе. Нитросативный стресс характеризуется суперпродукцией NO∙, который часто усугубляет эффекты избыточной продукции супероксидного аниона.
Супероксидный радикал может возникать в процессе биохимических реакций (окисление с помощью флавопротеинов, в цепях монооксигеназных реакций и др.).
Свободные радикалы инициируют цепные реакции. Если в реакцию вступают ненасыщенные жирные кислоты, то говорят о пероксидном окислении липидов (ПОЛ). Этот процесс важен для развития патологических состояний, связанных с повреждением мембран. Схема цепных реакций:
1. Инициация при действии R×, металлов, излучений: Х×+RH®R×+XH.
2. Удлинение, разветвление: R× + O2® ROO× (пероксидный радикал). ROO× + RH ® R× + ROOH (гидроперекись) и т.д.
3. Терминация (обрыв цепи): ROO× + R1× ® ROOR1; R× + R1×® RR1.
Применительно к фрагменту ненасыщенной жирной кислоты можно показать ранние, средние и поздние продукты пероксидного окисления. Во всех полиненасыщенных жирных кислотах присутствует дивинилметановая структура, которая легко вступает в реакцию отрыва протона, сопровождающуюся образованием свободного радикала. Ранние продукты ПОЛ – диеновые конъюгаты; средние продукты ПОЛ – гидроперекиси; конечный продукт ПОЛ – малоновый диальдегид. Эти процессы лежат в основе повреждения мембран клеток.
Антиоксидантная защита. Сдерживание процессов свободно-радикального окисления осуществляется с помощью неферментативных и ферментативных механизмов.
1. Неферментативная защита включает: комплексоны, связывающие металлы (этилендиаминотетрауксусная кислота); в водной фазе – витамин С, ураты, ароматические амины, SH-соединения; в липидной фазе – жирорастворимые витамины А (b-каротин), Е, гормоны стероидной природы, тироксин.
2. Ферментативная защита включает фермент супероксиддисмутазу (в цитозоле, ядрах и лизосомах простетическая группа – Cu2+, Zn2+, в митохондриях и у бактерий – Mn2+) 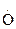
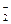 +
+ 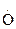
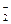 +2Н+®Н2О2 + О2. Перекись водорода обезвреживается в каталазной или пероксидазной (чаще глутатионпероксидазной) реакциях. Активатор реакции – Se. В продукты питания добавляют антиоксидантные добавки: b-каротин, a-токоферол, ВНА – бутиловый гидроксианизол, ВНТ – бутиловый гидрокситолуен. Для профилактики радиационных поражений используют комплексы витаминов А, Е, С и b-каротин, Е, С.
+2Н+®Н2О2 + О2. Перекись водорода обезвреживается в каталазной или пероксидазной (чаще глутатионпероксидазной) реакциях. Активатор реакции – Se. В продукты питания добавляют антиоксидантные добавки: b-каротин, a-токоферол, ВНА – бутиловый гидроксианизол, ВНТ – бутиловый гидрокситолуен. Для профилактики радиационных поражений используют комплексы витаминов А, Е, С и b-каротин, Е, С.
