Физические свойства аренов.
ЛЕКЦИЯ №36.
Арены.
План:
1. Общая характеристика аренов.
2. Номенклатура аренов.
3. Изомерия аренов.
4. Физические свойства аренов.
5. Cпособы получения аренов.
6. Отдельные представители и их применение.
7. Химические свойства бензола
Общая характеристика аренов.
Ароматическими называют соединения, в молекулах которых имеется циклическая группа атомов с особым характером связи – ядро бензола.
Простейшим представителем аренов является бензол, его эмпирическая формула С6Н6. Общая формула моноциклических аренов СnH2n-6 показывает, что они являются ненасыщенными соединениями.
В 1865 году немецкий химик Кекуле предложил циклическую формулу бензола с сопряженными связями ( чередуются простые и двойные связи ):
СН

 НС СН
НС СН
 |
 НС СН
НС СН
СН
циклогексантриен – 1,3,5
Такая формула не объясняла многие свойства бензола:
1) Для бензола характерны реакции замещения, а не реакции присоединения.
Реакции присоединения возможны, но они протекают труднее, чем у алкенов.
2) Бензол не вступает в реакции, являющиеся качественными на непредельные углеводороды (с бромной водой и раствором КМnO4.
Электронографические исследования, проведенные позже, показали, что все связи между атомами углерода в молекуле бензола имеют одинаковую длину 0,140 нм (среднее значение между длиной простой связи С – С 0,154 нм и двойной связи С ═ С 0,134 нм ). Угол между связями у каждого атома углерода равен 120º. Молекула представляет собой правильный плоский шестиугольник.
Современная теория для объяснения строения молекулы С6Н6 использует представление о гибридизации орбиталей атома углерода.
Атомы углерода в бензоле находятся в состоянии sp2 – гибридизации. Каждый атом «С» образует три σ- связи (две с атомами углерода и одну с атомом водорода). Все σ – связи находятся в одной плоскости:
Каждый атом углерода имеет один
р-электрон, который не участвует Н
в гибридизации. Негибридизированные │
р-орбитали атомов углерода находятся С
в плоскости, перпендикулярной 
 Н Н
Н Н
плоскости σ-связей. Каждое р-облако  С С
С С
перекрывается с двумя соседними
р-облаками и в результате образуется 120
единая сопряженная π-система.
 С С
С С
Н Н
С
│
Н
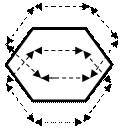
Сочетание шести σ-связей с единой π- -системой называется
ароматической связью. Цикл из шести атомов углерода, свя-
занных ароматической связью, называется бензольным кольцом,
или бензольным ядром.
Номенклатура аренов.
Гомологи ароматических углеводородов надо рассматривать как производные бензола, в которых один или несколько атомов водорода замещены различными углеводородными радикалами.
С6Н5─ СН3 С6Н5─ С2Н5 С6Н4(СН3)2
метилбензол этилбензол диметилбензол
(толуол) (ксилол)
Радикал бензола имеет формулу —С6Н5 и называется фенил.
Изомерия аренов.
Для аренов характерна изомерия двух видов:
1) изомерия числа и строения заместителей;
2) изомерия положения заместителей ( орто-, мета-, пара-изомерия).
Так как в бензоле все атомы углерода равноценны, то у первого гомолога метилбензола изомеры отсутствуют. У второго изомера диметилбензола имеются три изомера:





 1 CH3 1 CH3 1 CH3
1 CH3 1 CH3 1 CH3



 6 2 CH3 6 2 6 2
6 2 CH3 6 2 6 2
5 3 5 3—— CH3 5 3
 4 4 4 CH3
4 4 4 CH3
1,2 – диметилбензол 1,3 – диметилбензол 1,4 – диметилбензол
орто-диметилбензол мета-диметилбензол пара-диметилбензол
орто- ксилол мета-ксилол пара-ксилол
Орто-изомеры – это изомеры, в которых заместители находятся у соседних атомов угле-рода.
Мета-изомеры – это изомеры, в которых заместители разделены одним атомом углерода.
Пара-изомеры – это изомеры, в которых заместители разделены двумя атомами углерода
бензольного кольца.
 С8Н10
С8Н10







 а)С2Н5 б) СН3 в) СН3 г) СН3
а)С2Н5 б) СН3 в) СН3 г) СН3



 ─ СН3
─ СН3
 | |||
 | |||

 СН3 СН3
СН3 СН3


изомерия положения заместителей


 ( орто-, мета-, пара-изомерия)
( орто-, мета-, пара-изомерия)
изомерия числа и строения заместителей
Физические свойства аренов.
Все арены имеют плотность меньше 1, то есть все они легче воды и в воде не растворимы.
Cпособы получения аренов.
Арены получают в промышленности:
