По средней длине углеродной цепи
Стандартной температурой самовоспламенения паров жидкости в воздухе называется определенная стандартным методом самая низкая температура, до которой должна быть нагрета наиболее легковоспламеняемая смесь (смесь близкая к стехиометрической) данного газа или пара с воздухом, чтобы она воспламенилась без внесения в нее постороннего источника зажигания.
Температура самовоспламенения (ТСВ) определяется по таблицам, исходя из средней длины углеродной цепи в молекуле данного класса соединений. Расчетная формула условной средней длины углеродной цепи в молекуле имеет вид:
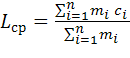 (4.1.1)
(4.1.1)
Здесьci - длина i - ой углеродной цепи в молекуле;
mi - число углеродных цепей, длина которых составляет ci;
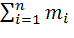 - общее число углеродных цепей в молекуле. Оно находится по формуле:
- общее число углеродных цепей в молекуле. Оно находится по формуле:
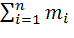 =
= 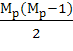 (4.1.2)
(4.1.2)
В формуле (4.1.2) Мр - число концевых групп в молекуле.
Концевыми группами являются:
- в молекуле парафинового углеводорода метильные группы – СН3;
- в молекуле спирта – метильные и гидроксильные ОН;
- в молекуле ароматического углеводорода – метильные группы и ароматическое кольцо. Ароматическое кольцо считают только концевой групп
пой, если в нем замещен только один атом водорода. Если в ароматическом кольце замещены два и более атомов водорода, то его считают и концевой и промежуточной группой.
Расчет длины углеродных цепей для каждого класса соединений имеет свои особенности. При подсчете числа атомов углерода в каждой цепи применяются следующие правила:
а) для парафинов расчетное число атомов углерода в цепи равно фактическому числу атомов углерода;
б) для спирта расчетное число атомов углерода в цепи, включающей ОН-группу равно фактическому числу атомов углерода, увеличенному на единицу;
в) для ароматического углеводорода расчетное число атомов углерода в цепи, включающей ароматическое кольцо, равно фактическому числу атомов углерода в цепи, уменьшенному на единицу. Атомы углерода ароматического кольца при подсчете длины углеродной цепи не учитываются.
В зависимости от полученного значения Lср по таблице для данного класса соединений определяют температуру самовоспламенения.
4.2. Расчет йодного числа жиров, масел и других веществ
Йодное число – это масса йода, поглощенная 100 граммами жира или масла. Йодное число характеризует количество глицеридов непредельных кислот, содержащихся в масле или жире. Оно является критерием склонности жиров и масел к самовозгоранию. Масла, имеющие йодное число более 50, считаются склонными к самовозгоранию.
Пример. Определить йодное число льняного масла, содержащего 5 % (по массе) глицеридов пальмитиновой и стеариновой кислот, 18 % глицерида олеиновой кислоты, 30 % глицерида линолевой кислоты и 47 % глицерида линоленовой кислоты.
Решение.
Глицериды пальмитиновой и стеариновой кислот являются предельными, поэтому при низких температурах они не присоединяют йод.
Определяем количество йода, присоединяющегося к глицериду олеиновой кислоты.
Уравнение реакции: (С17Н33СОО)3С3Н5+ 3 I2 = (С17Н33I2СОО)3С3Н5
Молекулярная масса глицерида олеиновой кислоты 884 г/моль, йода 254 г/моль.
К 884 г глицерида олеиновой кислоты присоединяется 254 × 3 г йода.
К 18 г глицерида олеиновой кислоты (столько содержится в 100 г масла) присоединяется Х1 г йода.
Х1 = 254 × 3 ×18/884 = 15,5 г
Определяем количество йода, присоединяющегося к глицериду линолевой кислоты.
Уравнение реакции: (С17Н31СОО)3С3Н5+ 6 I2 = (С17Н33I4СОО)3С3Н5
Молекулярная масса глицерида линолевой кислоты 878 г/моль.
К 878 г глицерида олеиновой кислоты присоединяется 254 × 6 г йода.
К 30 г глицерида линолевой присоединяется Х2 г йода
Х2 = 254 × 6 × 30/878 = 52,1 г
Определяем количество йода, присоединяющегося к глицериду линоленовой кислоты.
Уравнение реакции: (С17Н29СОО)3С3Н5+ 9 I2 = (С17Н33I6СОО)3С3Н5
Молекулярная масса глицерида линоленовой кислоты 872 г/моль.
К 872 г глицерида олеиновой кислоты присоединяется 254 × 9 г йода.
К 47 г глицерида линоленовой присоединяется Х3 г йода
Х2 = 254 × 9 × 47/872 = 123,2 г
Йодное число льняного масла равно:
И.ч. = Х1 + Х2 + Х3 = 15,5 + 52,1 + 123,2 = 190,8 г
5.Основные параметры взрыва
5.1. Расчёт температуры и давления взрыва
Теплота взрыва определяется как сумма внутренней энергии взрывчатой смеси UСМ и теплоты сгорания данного вещества QГ:
QВЗР = UСМ + QГ (5.1.1)
Величина UСМ равна сумме произведений количества, изохорной теплоемкости (при постоянном объёме) и начальной температуры компонентов взрывчатой смеси.
UСМ .= n1 CV1×T0 + n2 CV2×T0 +…+ nn CVn×T0 (5.1.2)
Здесь CV1, CV2, CVn - мольная изохорная теплоёмкость компонентов исходной взрывчатой смеси, кДж/(кг×К);
Т0 - начальная температура смеси, К.
Для веществ в газообразном агрегатном состоянии мольная изохорная теплоемкость компонента может быть вычислена по формуле:
CV = СP – R (5.1.3)
где Ср — мольная изобарная теплоемкость (при постоянном давлении);
R = 8,31 Дж/(моль×К) - универсальная газовая постоянная.
При горении газовых смесей в закрытом объёме продукты горения не совершают работу расширения. Энергия взрыва расходуется только на нагрев продуктов взрыва. Поэтому теплота взрыва будет равна сумме внутренних энергий продуктов взрывчатого горения:
QВЗР = UПГ = 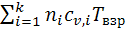 (5.1.4)
(5.1.4)
Произведения 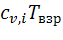 находят по справочным таблицам.
находят по справочным таблицам.
Температуру взрыва газовых смесей при постоянном объёме вычисляют по методу расчёта температуры горения смеси при постоянном давлении, то есть методом последовательных приближений, учитывая что 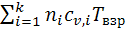 не может превышать QВЗР.
не может превышать QВЗР.
По температуре взрыва находят давление взрыва:
РВЗР = 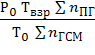 (5.1.5)
(5.1.5)
Давление при взрыве газо-воздушной смеси в закрытом объеме зависит от соотношения температуры взрыва и начальной температуры, отношения числа молекул продуктов горения 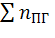 к числу молекул исходной смеси
к числу молекул исходной смеси 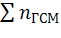 . При взрыве газо-воздушной смеси давление обычно не превышает 1,0 МПа, если первоначальное давление смеси было нормальным.
. При взрыве газо-воздушной смеси давление обычно не превышает 1,0 МПа, если первоначальное давление смеси было нормальным.
Значение максимального давления взрыва используют в расчётах предохранительных клапанов, взрывных мембран и оболочек взрывонепроницаемого электрооборудования.
Литература
1. ГОСТ - 12.1.044.- 89. Пожаровзрывоопасность веществ и материалов. Номенклатура показателей и методы их определения. - М.: Издательство стандартов, 1990.
2. Процессы горения /Абдурагимов И.М. и др. М.: ВИПТШ, 1984.
3. Горшков В.И. Самовозгорание веществ и материалов. – М.: ВНИИПО, 2003. – 446 с.
4. Корольченко А.Я., Корольченко Д.А. Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник: в 2-х ч. – 2-е изд., перераб. и доп. – М.: Асс. «Пожнаука», 2004
5. Корольченко А.Я. Процессы горения и взрыва. – М.: Пожнаука, 2007. – 266 с. ил.
6. Материальный баланс процесса горения. Методические указания по курсу «Теория горения и взрыва» / сост. Д.Г.Снегирев. Иваново: ИФА ГПС МЧС РФ, 2002.
7. Тепловой баланс процесса горения. Методические указания по курсу «Теория горения и взрыва» / сост. Д.Г.Снегирев. Иваново: ИФА ГПС МЧС РФ, 2002.
8. Основы теории самовоспламенения. Самовозгорание веществ и материалов / сост. А.В. Петров, Т.А. Мочалова, Д.В.Батов. - Иваново: ООНИ ИвИ ГПС МЧС России, 2008. – 64 с.
| Составители: Батов Дмитрий Вячеславович Мочалова Татьяна Александровна Петров Андрей Вячеславович |
