Краткие теоретические сведения. Химическая кинетика изучает механизм и скорость протекания химических реакций
Химическая кинетика изучает механизм и скорость протекания химических реакций. В зависимости от типа системы различают гомогенные реакции (протекают с одинаковой скоростью по всему объему) и гетерогенные реакции (идут на поверхности раздела фаз, так как только там имеется физический контакт между веществами).
Скорость реакции в данный момент времени, иначе мгновенная скорость реакции u, равна, 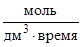 :
:
u = 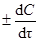 ,
,
где dС – дифференциально-малое изменение концентрации за дифференциально-малый промежуток времени dt; знак минус относится к концентрации исходного вещества, а знак плюс – к концентрации продукта.
В ходе реакции нет необходимости следить за концентрациями всех участников реакции, так как стехиометрическое уравнение устанавливает соотношение между концентрациями всех реагентов. Так, для гомогенной реакции общего вида аА + bВ ® dD + mM скорости изменения концентраций реагентов связаны между собой соотношением
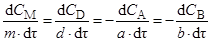 .
.
Скорость реакции зависит от природы взаимодействующих веществ, концентраций реагентов, температуры, присутствия в системе катализатора и др. Зависимость скорости реакции от концентраций реагентов устанавливает основной закон химической кинетики: при постоянной температуре мгновенная скорость реакции u прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях своих частных порядков реакции.
Математическая запись закона для гомогенной реакции общего вида (иначе кинетическое уравнение реакции) будет отражаться уравнением
u = k×[А] 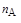 ×[В]
×[В] 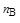 ,
,
где k – константа скорости реакции; [А], [В] – концентрации реагентов, моль/дм3; nА, nВ – порядок реакции по веществам А и В соответственно.
Для гетерогенных систем в кинетическое уравнение реакции не включают концентрации твердых реагентов, так как в ходе процесса они практически не изменяются и учтены в k.
Константа скорости реакции зависит от тех же факторов, что и u, кроме концентраций веществ. k численно равна скорости реакции, когда концентрации реагентов одинаковые и равны 1 моль/дм3. Единицы измерения k зависят от порядка реакции.
Порядком реакции n называют сумму показателей степеней при концентрациях в кинетическом уравнении реакции. Так, для реакции общего вида порядок реакции n = nА + nВ .
По механизму взаимодействия реакции делят на простые и сложные. Простые – это реакции, протекающие необратимо в одну стадию, при этом уравнение реакции полностью отражает механизм взаимодействия веществ. Все остальные реакции являются сложными. Для простых реакций n равен сумме стехиометрических коэффициентов в уравнении реакции. Например, если реакция аА + bВ ® продукты простая, то кинетическое уравнение данной реакции имеет вид:
u = k×[А]а ×[В]b,
а порядок реакции n = а + b. Для простых реакций основной закон химической кинетики называется законом действующих масс.
Все гетерогенные и многие гомогенные реакции являются сложными. В этом случае закон действующих масс выполняется для каждой стадии отдельно, а общая скорость процесса будет равна наиболее медленной стадии, которую называют лимитирующей.
Повышение температуры ускоряет большинство химических реакций. Приближенно влияние температуры на скорость реакции описывает эмпирическое правило Вант-Гоффа: при повышении температуры на 10 К скорость большинства реакций увеличивается в 2¸4 раза
u2 = u1× 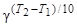 ,
,
где u1, u2 – скорости реакции при температурах Т1 и Т2; g - температурный коэффициент Вант-Гоффа, который показывает во сколько раз увеличивается скорость реакции при повышении температуры на 10 К.
Для многих реакций в интервале температур от комнатных значений до 400 °С температурный коэффициент лежит в пределах от 2 до 4. Точнее значение g можно вычислить по формуле
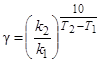 ,
,
где k1, k2 – константы скорости реакции при температурах Т1 и Т2.
Более строгая зависимость скорости реакции от температуры описывается уравнением Аррениуса
k =k0× 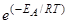 ,
,
где k – константа скорости реакции при температуре Т; k0 – предэкспоненциальный множитель; е – основание натурального логарифма; ЕА – энергия активации, Дж/моль.
Энергией активации называют избыток энергии, которым должны обладать молекулы, по сравнению со средним значением энергии частиц в системе, чтобы их столкновение привело к образованию продуктов реакции. Величина энергии активации зависит от природы реагирующих веществ. Для химических реакций значения ЕА лежат в пределах 40¸400 кДж/моль. В узком интервале температур энергия активации практически не зависит от температуры и может быть вычислена по формуле
ЕА = 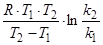 .
.
Реакции, которые могут одновременно протекать в прямом и обратном направлениях, называются обратимыми. Состояние системы, когда скорость прямой реакции 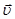 равна скорости обратной реакции
равна скорости обратной реакции 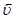 , называется химическим равновесием. Для гомогенной реакции вида аА + вВ « dD + mM, находящейся в состоянии равновесия, будет выполняться соотношение
, называется химическим равновесием. Для гомогенной реакции вида аА + вВ « dD + mM, находящейся в состоянии равновесия, будет выполняться соотношение
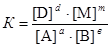 ,
,
где [A], [B], [D], [M] – концентрации участников реакции, установившиеся к моменту равновесия, иначе равновесные концентрации, моль/дм3; К – константа химического равновесия.
Это уравнение является вариантом математической записи закона действующих масс для химического равновесия:при постоянной температуре отношение произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам, является величиной постоянной.
Если все участники реакции являются газообразными веществами, то вместо равновесных концентраций удобнее пользоваться равновесными парциальными давлениями компонентов РА, РВ, РDи РM, тогда закон действующих масс пример вид
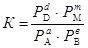 .
.
Для гетерогенных реакций закон действующих масс выполняется при условии, что в уравнения констант равновесия не входят равновесные концентрации (парциальные давления) твердых исходных веществ и продуктов реакции. Например, для гетерогенной реакции
Сграфит + 2Н2Огаз « СО2, газ + 2Н2, газ
константа равновесия выражается уравнением
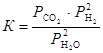 .
.
Константа химического равновесия зависит от природы реагирующих веществ и от температуры. Влияние температуры на К определяется знаком теплового эффекта реакции. Для эндотермической реакции (DН > 0) при повышении Т константа равновесия увеличивается, и наоборот, для экзотермической реакции (DН < 0) при возрастании температуры К уменьшается.
В целях более полного превращения исходных веществ в продукты, довольно часто возникает необходимость смещения равновесия в сторону прямой реакции.
При изменении условий проведения реакции смещение химического равновесия в сторону прямой или обратной реакции происходит в соответствии с принципом Ле Шателье: если в равновесной смеси изменить концентрацию одного из реагирующих веществ, температуру или давление, то равновесие смещается в направлении той реакции (прямой или обратной), которая ослабляет эффект от данного воздействия на равновесную систему.
Влияние концентраций (парциальных давлений) компонентов на сдвиг равновесия. При повышении концентрации исходного вещества ускоряется прямая реакция, что приводит к росту концентраций продуктов и уменьшению концентраций исходных веществ, то есть смешению равновесия в сторону прямой реакции (вправо). И, наоборот, при увеличении концентрации продукта реакции равновесие смещается в сторону обратного процесса (влево). Для гетерогенного равновесия изменение концентраций твердых фаз не влияет на сдвиг равновесия.
Влияние температуры на сдвиг равновесия. С увеличением температуры равновесие смещается в сторону того процесса, который идет с поглощением тепла, то есть в сторону эндотермической реакции.
Влияние общего давления на сдвиг равновесия. Изменение общего давления влияет на равновесие только для тех реакций, которые протекают с изменением числа моль газообразных веществ. В соответствии с принципом Ле Шателье увеличение общего давления в системе смещает равновесие в том направлении, где происходит уменьшение числа моль газов.
Примеры решения задач
Пример 1. Для простой реакции А + 2В® D начальные концентрации А и В равны 0,03 и 0,05 моль/дм3. Константа скорости реакции равна 0,4 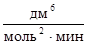 . Вычислите начальную скорость реакции и скорость реакции, когда концентрация вещества А уменьшится на 0,01 моль/дм3.
. Вычислите начальную скорость реакции и скорость реакции, когда концентрация вещества А уменьшится на 0,01 моль/дм3.
Р е ш е н и е
Кинетическое уравнение данной реакции имеет вид
u = k×[A]×[B]2.
Тогда скорость реакции в начальный момент времени равна
u0 = 0,4×0,03×(0,05)2 = 3×10-5 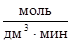 .
.
Определим концентрации реагентов, когда концентрация А уменьшится на 0,01 моль/дм3. Концентрация вещества А будет равна разности между начальным значением и израсходованным
[A] = 0,03 – 0,01 = 0,02 моль/дм3.
Согласно уравнению реакции расход по веществу В в два раза больше относительно расхода вещества А, поэтому
[B] = 0,05 – 2×0,01 = 0,03 моль/дм3.
Тогда скорость реакции
u = 0,4×0,02×(0,03)2 = 7,2×10-6 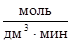 .
.
Пример 2. Во сколько раз изменится скорость реакции 2NO + O2 = 2NO2, если при Т = const повысить общее давление в 2 раза?
Р е ш е н и е
Поскольку все участники реакции являются газообразными веществами, то увеличение общего давления в 2 раза при постоянной температуре вызовет уменьшение объема системы в 2 раза, то есть концентрация каждого из веществ увеличится в 2 раза. Согласно закону действующих масс скорость реакции до повышения давления равна
u1 = k×[NO]2×[O2],
а после повышения давления
u2 = k×(2[NO])2×2[O2] = 8k×[NO]2×[O2].
Так как k не зависит от концентраций реагентов, то 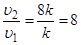 , то есть, при повышении давления в 2 раза скорость реакции увеличится в 8 раз.
, то есть, при повышении давления в 2 раза скорость реакции увеличится в 8 раз.
Пример 3.Для реакции 2NO + Cl2 = 2NOCl (все вещества газы) начальные концентрации реагентов одинаковые и равны 0,2 моль/дм3. Определите константу скорости реакции, если в момент, когда разлагается 25 % хлора, скорость реакции равна 7,8×10–3 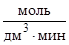 .
.
Р е ш е н и е
Определим концентрацию Cl2, когда его расход составит 25 %
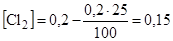 моль/дм3.
моль/дм3.
Определим концентрацию NO, учитывая, что расход NO в 2 раза больше расхода хлора
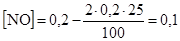 моль/дм3.
моль/дм3.
Запишем кинетическое уравнение данной реакции
u = k×[NO]2×[Cl2].
Отсюда определяем константу скорости реакции
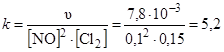
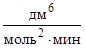 .
.
Пример 4. При 150 °С реакция заканчивается за 16 минут. Определите время, необходимое для протекания реакции при 200 °С, если температурный коэффициент Вант-Гоффа равен 2,5.
Р е ш е н и е
Между скоростью протекания химической реакции и ее продолжительностью существует обратно пропорциональная зависимость
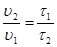 ,
,
тогда правило Вант-Гоффа в данном случае можно записать в виде
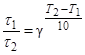 , откуда
, откуда 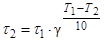
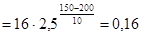 мин.
мин.
Пример 5.Вычислите энергию активации реакции, если при повышении температуры от 290 К до 320 К скорость реакции увеличивается в 7 раз.
Р е ш е н и е
Согласно основному закону химической кинетики, скорость реакции и константа скорости реакции прямо пропорциональны друг другу, то есть выполняется соотношение
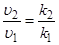
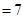 .
.
Подставим это в формулу для расчета энергии активации
ЕА = 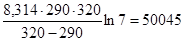 Дж/моль.
Дж/моль.
Пример 6. В состоянии равновесия для реакции N2 + 3H2 « 2NH3 концентрации участников равны (моль/дм3): [N2] = 3; [H2] = 9; [NH3] = 4. Вычислите константу равновесия реакции и определите исходные концентрации азота и водорода, полагая, что до начала реакции аммиак в системе отсутствовал.
Р е ш е н и е
Данная реакция является гомогенной, поэтому константа равновесия
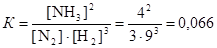
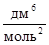 .
.
Из уравнения реакции следует, что для образования 4 моль продукта требуется 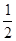 × 4 = 2 моль азота и
× 4 = 2 моль азота и 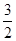 × 4 = 6 моль водорода. Следовательно, исходная концентрация азота составляет [N2]0 = 3 + 2 = 5 моль/дм3, а исходная концентрация водорода равна [H2]0 = 9 + 6 = 15 моль/дм3.
× 4 = 6 моль водорода. Следовательно, исходная концентрация азота составляет [N2]0 = 3 + 2 = 5 моль/дм3, а исходная концентрация водорода равна [H2]0 = 9 + 6 = 15 моль/дм3.
Пример 7. Константа равновесия реакции FeOтв + СО « Feтв + СО2 при некоторой температуре равна 0,5. Определите равновесные концентрации газов, если до начала реакции газовая смесь содержала 0,05 моль/дм3 СО и 0,01 моль/дм3 СО2.
Р е ш е н и е
Для данной гетерогенной реакции константа равновесия определяется выражением 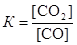 . Пусть к моменту равновесия в реакцию вступило х моль СО. Тогда, согласно уравнению реакции, образовалось столько же моль СО2. Следовательно, равновесные концентрации газов будут равны, моль/дм3:
. Пусть к моменту равновесия в реакцию вступило х моль СО. Тогда, согласно уравнению реакции, образовалось столько же моль СО2. Следовательно, равновесные концентрации газов будут равны, моль/дм3:
[CO] = 0,05 – х ; [CO2] = 0,01 + х .
Подставим эти концентрации в выражение для константы равновесия
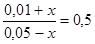 или
или 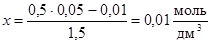 .
.
Таким образом, [CO] = 0,05 – 0,01 = 0,04 моль/дм3;
[CO2] = 0,01 + 0,01 = 0,02 моль/дм3.
Пример 8. Константа равновесия реакции Н2 + I2 « 2HI равна 64,8. Определите равновесные концентрации компонентов, если исходная смесь содержала 1,4 моль/дм3 водорода и 1,0 моль/дм3 йода.
Р е ш е н и е
Выражение для константы равновесия данной реакции имеет вид
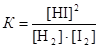 .
.
Пусть к моменту равновесия образовалось х моль HI. Тогда, согласно уравнению реакции, было израсходовано по 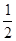 х моль йода и водорода. Следовательно, можно составить уравнение
х моль йода и водорода. Следовательно, можно составить уравнение
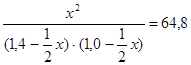 или 15,2 х2 – 77,76 х + 90,72 = 0.
или 15,2 х2 – 77,76 х + 90,72 = 0.
Решение данного уравнения даст корни, моль/дм3: х1 = 3,32; х2 = 1,8. Первый корень не удовлетворяет условию задачи по физическому смыслу (концентрация HI не может быть больше, чем удвоенная концентрация йода или водорода, то есть 2 или 2,8 моль/дм3). Таким образом, используем второй корень уравнения. Равновесные концентрации компонентов равны, моль/дм3:
[HI] = 1,8; [H2] = 1,4 – 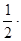 1,8 = 0,5; [I2] = 1,0 –
1,8 = 0,5; [I2] = 1,0 – 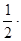 1,8 = 0,1.
1,8 = 0,1.
Пример 9.Какие меры следует предпринять для повышения выхода продукта реакции N2 + 3H2 « 2NH3 ; DН 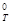 = –92,4
= –92,4 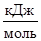 .
.
Р е ш е н и е
По условию задачи требуется сместить равновесие в сторону прямой реакции, поэтому следует:
1) увеличивать концентрации азота и водорода, то есть постоянно водить в систему свежие порции реагентов; уменьшать концентрацию аммиака, иначе выводить его из реакционного пространства;
2) понижать температуру, так как прямая реакция является экзотермической;
3) увеличивать давление (уменьшать объем), потому что в прямом направлении происходит уменьшение числа моль газообразных веществ (из 4 моль газа образуется 2 моль).
Пример 10. Как изменится равновесная концентрация кислорода, если в системе 2Ств + О2 « 2СО при постоянной температуре увеличить концентрацию СО в 3 раза?
Р е ш е н и е
Запишем выражение для константы равновесия данного гетерогенного процесса 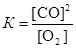 . По условию задачи
. По условию задачи 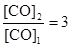 . Поскольку константа равновесия не зависит от концентраций реагентов, то должно выполняться равенство
. Поскольку константа равновесия не зависит от концентраций реагентов, то должно выполняться равенство
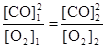 или
или 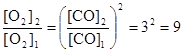 .
.
Таким образом, при повышении концентрации СО в 3 раза равновесная концентрация кислорода должна увеличится в 9 раз.
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
