Поясните, почему изменяются температуры кипения и замерзания растворов по сравнению с растворителем.
Из графика (см. рисунок 3)также видно, что температура кипения раствора выше температуры кипения чистого растворителя.Под температурой кипения подразумевается та температура, при которой давление насыщенного пара равно внешнему давлению.Поэтому она различна: для чистой воды – это температура Т1, а для раствора – Т2.
Для разбавленных растворов при понижении температуры (см. рисунок 3)первым начинает кристаллизоваться чистый растворитель.Это происходит тогда, когда давление пара над раствором станет равно насыщенному пару над кристаллом (линия О–В). Температура начала кристаллизации для раствора состава С1соответствует температуре Т3, а для состава С2– Т4. При увеличении концентрации растворенного вещества температура замерзания уменьшается, что также хорошо видно на Р–Т–диаграмме (см. рисунок 3).
Кривые давления пара над растворами тем больше удалены от соответствующей кривой воды, чем концентрированнее раствор. Поэтому и разность между температурами кипения или замерзания воды и раствора тем больше, чем выше концентрация раствора.
Изучая замерзание и кипение растворов, Рауль установил, что для разбавленных растворов неэлектролитов повышение температуры кипения и понижение температуры замерзания пропорциональны концентрации раствора.
Второй закон Рауля: повышение температуры кипения (понижение температуры замерзания) раствора по сравнению с температурой кипения (замерзания) растворителя пропорционально моляльной концентрации растворенного вещества.
Математически эти изменения температуры можно рассчитать по формулам:
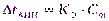 ;
;
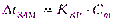 ;
;
где КЭ – эбулиоскопическая (от лат. ebullire – кипеть) постоянная растворителя; ККР – криоскопическая (от греч. сrios – холод) постоянная растворителя; 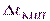 – повышение температуры кипения;
– повышение температуры кипения; 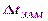 –понижение температуры замерзания; Сm – моляльная концентрация растворенного вещества.
–понижение температуры замерзания; Сm – моляльная концентрация растворенного вещества.
Если расписать Сm, то формулы примут вид:
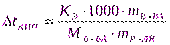 ;
;
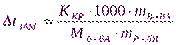 .
.
Физический смыслэбулиоскопической и криоскопической постоянных определяется следующим образом. Их числовые значения показывают, на сколько градусов выше кипит и на сколько градусов ниже замерзает одномоляльный раствор (содержащий 1 моль растворенного вещества в 1000 грастворителя) по сравнению с температурами кипения и замерзания чистого растворителя. Единицы измерения – 1 град·моль-1·кг.
Эбулиоскопическая и криоскопическая константы не зависят от природы растворенного вещества, а являются характеристиками растворителя. Их значения для некоторых растворителей приведены в таблице 1.
Таблица 1 – Криоскопические и эбулиоскопические константы некоторых растворителей
| Растворитель | tКИП, °С | КЭ, град·моль-1·кг | tЗАМ, °С | ККР, град·моль-1·кг |
| Вода (Н2О) Бензол (С6Н6) Хлороформ (СНСl3) Сероуглерод (СS2) Тетрахлорид углерода (ССl4) | 80,1 61,7 46,2 76,5 | 0,52 2,53 3,63 2,34 5,03 | 5,5 -63,5 -111,5 -23 | 1,86 5,12 4,70 3,83 |
На измерениях температур кипения и замерзания растворов основаны эбулиоскопический и криоскопический методы определения молекулярных масс веществ. Эти два метода широко используются в химии, так как, применяя различные растворители, можно определять молекулярные массы разнообразных веществ.
Для определения молярной массы растворенного вещества удобно пользоваться следующим соотношением:
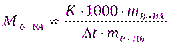 ,
,
где 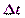 – повышение температуры кипения или понижение температуры замерзания раствора по сравнению с соответствующими характеристиками чистого растворителя;
– повышение температуры кипения или понижение температуры замерзания раствора по сравнению с соответствующими характеристиками чистого растворителя;
К – эбулиоскопическая или криоскопическая константа.
Способность растворов замерзать при более низкой температуре, чем растворитель, используется при приготовлении низкозамерзающих растворов, которые называются антифризами.Антифризами заменяют воду в радиаторах автомобильных и авиационных моторов в зимнее время. В качестве основных компонентов могут быть использованы т. н. многоатомные спирты – этиленгликоль и глицерин:
СН2— СН2 СН2— СН2— СН2
| | | | |
ОН ОН ОН ОН ОН
этиленгликоль глицерин
Водный раствор этиленгликоля (58-процентный по массе), например, замерзает только при температуре минус 50 °С.
