Стекла и другие аморфные тела
Минимальному значению свободной энергии соответствует кристаллическое состояние твердых тел. Однако атомы не всегда имеют благоприятную возможность располагаться упорядоченно в процессе затвердевания. Препятствием этому может быть резкое уменьшение скорости диффузии атомов при охлаждении среды.
Твердые тела, которые характеризуются случайным хаотичным расположением частиц, называют аморфными. В отличие от кристаллов аморфные тела изотропны по свойствам, не имеют определенной температуры плавления и характеризуются достаточно широким температурным интервалом размягчения.
Наглядным примером аморфных веществ могут служить стекла и многие пластики.
В стеклах при отсутствии периодичности в строении можно наблюдать определенный ближний порядок, т.е. закономерное расположение ближайших соседей относительно каждого атома (т.е. расположение атомов в первой координационной сфере), тогда как в кристаллах сохраняется дальний порядок.
Стеклообразное состояние можно рассматривать как состояние сильно переохлажденной жидкости, т.е. жидкости с очень высокой вязкостью. Именно высокая вязкость ограничивает диффузионную активность атомов и препятствует образованию кристаллической фазы. Однако такое состояние термодинамически неустойчиво. Поэтому при отжиге может происходить «расстекловывание» материала, т.е. переход в более устойчивое кристаллическое состояние.
Плотные упаковки
Объяснение строения кристаллов основано на представлениях о плотных упаковках. Для устойчивости кристаллической структуры требуется условие минимума его потенциальной энергии.
Одним из факторов, уменьшающих потенциальную энергию, является плотнейшая упаковка. Тенденция к осуществлению плотнейшей упаковки свойственна всем типам кристаллических структур, но сильнее всего она выражена в металлических и ионных структурах, где связи ненаправлены.
Если рассматривать атомы в кристалле как касающиеся шары, то наиболее плотно уложить их можно двумя способами, которые соответствуют кубической и гексагональной упаковкам. В одной плоскости задача имеет одно решение: вокруг центрального шара располагаются шесть шаров в вершинах правильного шестиугольника – рис. 2.3, а. Следующий ряд (сверху) надо укладывать на первый так, чтобы центры тяжести шаров попадали в промежутки между шарами первого ряда (в лунки) - рис.2.3, а – пунктир. Центры тяжести шаров второго ряда показаны черными кружками. До сих пор упаковка по кубическому и гексагональному типу совпадают.
Если шары третьего ряда (снизу от первого) уложить так, что их центры тяжести совпадут с центрами тяжести шаров верхнего ряда – рис.2.3, b, то получится плотнейшая гексагональная упаковка.
Если шары третьего ряда уложить так, что их центры тяжести придутся на позиции, отмеченные белыми кружками на рис.2.3, а, то получим плотнейшую кубическую упаковку рис. 2.3, с. На рис. 2.3, d и e показано расположение атомов первой координационной сферы в плотнейшей гексагональной и плотнейшей кубической упаковках.
В гексагональной упаковке треугольники верхнего и нижнего оснований повернуты в одну и ту же сторону, а в кубической – в разные. В гексагональной плотнейшей упаковке шары верхнего и нижнего рядов занимают «черные» позиции, а «белые» позиции остаются свободными. В результате по всей вертикали, проходящей через белые позиции, сохраняются незанятые места – люки, похожие на шахты лифтов. По этим люкам может происходить диффузия примесей. В кубической упаковке шары второго и третьего рядов поочередно занимают то белые, то черные позиции, уничтожая сквозные люки.
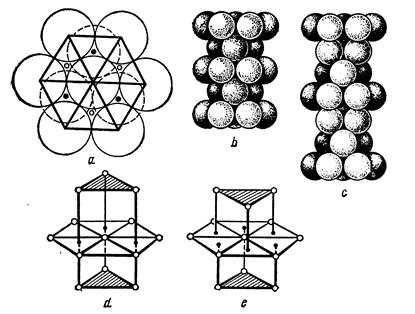
Рис.2.3. Плотные упаковки
В гексагональной упаковке чередуются два по-разному уложенных слоя АВАВАВ, а в кубической упаковке – три слоя АВСАВС.
Гексагональная плотная упаковка (ГПУ) изображена на рис. 2.4.
Элементарная ячейка ГПУ получится, если из шестигранной призмы вырезать третью часть: это призма, в основании которой лежит ромб с углом в 120º. Атомы расположены в вершинах призмы и один – внутри (в лунке, образованной тремя атомами, лежащими в основании призмы). Каждый атом окружен 12 соседями: шестью в той же плоскости, тремя снизу и тремя сверху (координационное число равно 12).
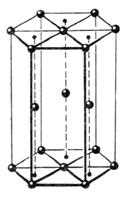
Рис.2.4. Плотноупакованная структура ГПУ
В ГПУ отношение высоты призмы к размеру в основании c/a = 1,633. ГПУ характерна для металлов Mg, Be, Zn, Cd, Tl, Ti, Zr, Hf, Sr и др.
Плотнейшая кубическая упаковка не сразу ассоциируется с гранецентрированной кубической элементарной ячейкой (ГЦК) – рис. 2.5: для этого нужно рассмотреть две смежные элементарные ГЦК ячейки. Центральный атом шестиугольника лежит на середине смежной грани двух ячеек и имеет 12 соседей (расположение атомов в вершинах правильного шестиугольника выделено пунктиром, а также выделены два треугольника, соответствующие рис. 2.3).
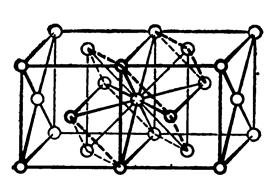
Рис.2.5. Плотноупакованная структура ГЦК
Плотноупакованные слои перпендикулярны направлениям <111> - пространственным диагоналям куба. В этой структуре все плоскости 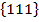 плотноупакованные, а лежащие в этих плоскостях направления <110> - диагонали граней - имеют наибольшую линейную плотность расположения атомов. Координационное число, так же, как в ГПУ, равно 12.
плотноупакованные, а лежащие в этих плоскостях направления <110> - диагонали граней - имеют наибольшую линейную плотность расположения атомов. Координационное число, так же, как в ГПУ, равно 12.
Плотноупакованной структурой ГЦК обладают металлы Cu, Au, Ag, Al, Pb, γ-Fe, Ca, Tl, Nb, α-Co, Ni, Pd, Ir, Pt и др.
Независимо от типа плотной упаковки (ГЦК или ГПУ) при помещении атома в лунку, образованную тремя атомами, расположенными в плоскости предыдущего слоя, центры всех четырех атомов образуют тетраэдр, показанный на рис. 2.6.
Центр тетраэдра является междоузлием (промежуточной позицией между атомами в элементарной ячейке). Междоузлия плотных упаковок бывают двух типов: октаэдрические и тетраэдрические (рис. 2.6 изображает тетраэдрическое междоузлие).
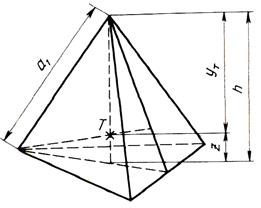
Рис.2.6. Тетраэдр, образуемый в плотной упаковке
На рис. 2.7 показано октаэдрическое междоузлие ГЦК решетки.
Октаэдрические междоузлия располагаются в центрах 12 ребер и в центре элементарной ячейки; всего их на одну элементарную ячейку приходится 12/4 + 1/1 = 4 (каждое междоузлие на ребре принадлежит четырем смежным элементарным ячейкам). Число их совпадает с числом атомов, приходящихся на элементарную ячейку: 8/8 + 6/2 = 4 (в вершинах куба 8 атомов, каждый из которых принадлежит 8 элементарным ячейкам, расположенные на шести гранях куба атомы принадлежат двум соседним ячейкам).
Тетраэдрические междоузлия располагаются в центрах 8 октантов (кубов с ребром, равным а/2, то есть объемом, равным 1/8 объема ячейки), всего их имеется в элементарной ячейке 8/1 = 8, вдвое больше, чем позиций атомов. На рис. 2.8 показаны все междоузлия ГЦК решетки.
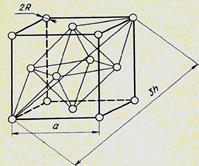
Рис.2.7. Октаэдрическое междоузлие в ГЦК решетке
(а - период решетки)
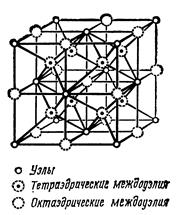
Рис.2.8. Октаэдрические и тетраэдрические
междоузлия в ГЦК решетке
Из геометрических соображений можно рассчитать радиусы шаров, которые помещаются в октаэдрические и тетраэдрические междоузлия ГЦК решетки с радиусом атома R и периодом решетки а – рис. 2.5 и рис.2.6.
Результаты расчета сведены в табл. 2.2.
Таблица 2.2
Расчет размеров тетраэдрических и октаэдрических междоузлий в ГЦК решетке
| Параметр | Формула для расчета |
| Период кристаллической решетки | .а = 2R 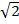 |
| Сторона тетраэдра | .а1 = 2R =0,71 a |
| Высота тетраэдра | .h = 2R 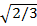 |
| Длина пространственной диагонали куба | D = 3h = 2R 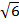 = a = a 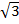 |
| Расстояние от центра тетраэдра до основания | .z = R/ 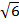 = 0,41R = 0,145a = 0,41R = 0,145a |
| Расстояние от центра тетраэдра до вершины | YT = h – z = 3/ 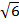 R = 0,433a R = 0,433a |
| Расстояние от центра октаэдра до вершины | YO = R 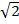 |
| Радиус тетраэдрического междоузлия | .rT = YT – R = 0,225R |
| Радиус октаэдрического междоузлия | .rO = YO – R = 0,414R |
Очень велика роль междоузлий в протекании различных физических процессах: атомы могут смещаться в междоузлия, диффундировать, передвигаясь по ним.
Позиции в междоузлиях могут целиком или частично быть занятыми атомами других элементов, что приводит к изменению свойств и к образованию других структур. Атомные структуры таких соединений удобно описывать на основе теории плотных упаковок.
Из бинарных соединений в кубической плотной упаковке с заполнением соответственно октаэдрических и тетраэдрических междоузлий кристаллизуются NaCl и ZnS (cфалерит) и многие им изоморфные вещества.
Другая модификация ZnS (вюрцит) имеет структуру, построенную на основе ГПУ, в которой заполнены тетраэдрические междоузлия. Исключительное многообразие структур на основе плотных упаковок обнаружено в полиморфных и политипных модификациях карбида кремния SiC
Теория плотных упаковок позволила расшифровать ряд сложных структур минералов, металлических соединений и сверхпериодических структур.
В пустотах между атомами плотных упаковок металлов могут располагаться Si, C, O, H, N, образуя силициды, карбиды, окислы, гидриды, нитриды.
Образование твердых растворов внедрения определяется возможностью размещения растворяемых атомов в тетра- и октаэдрических междоузлиях.
Принцип плотной упаковки остается справедливым и для ионных соединений: анионы образуют плотную упаковку, а катионы размещаются в междоузлиях.
Различие в плотных упаковках появляется в расположении атомов третьего слоя (например, при росте кристалла атом может занять не свою, а соседнюю лунку), поэтому в ГЦК решетке могут появляться гексагональные области.
Нарушение последовательности в расположении плотноупакованных атомных плоскостей называется дефектом упаковки, это поверхностный (двумерный ) дефект. Ввиду близости упаковок ГПУ и ГЦК некоторые металлы образуют обе структуры: Ca, Ni, Co.
Политипизм
Политипия (политипизм) – явление, характерное для некоторых плотноупакованных и слоистых структур.
Политипы – это структуры, построенные из одних и тех же слоев с разной последовательностью их чередования. Параметры решетки у политипов в плоскости слоя неизменны, а в направлении, перпендикулярном слоям, различны, но всегда кратны расстоянию между ближайшими слоями. Наиболее ярко политипизм проявляется в карбиде кремния. Кроме карбида кремния политипия встречается в графите, молибдените MoS2, PbS2 и других веществах со слоистой структурой.
