Определение перекиси водорода в растворе.
Перекись водорода в кислой среде окисляется перманганатом калия. Эквивалент перекиси водорода равен половине ее молекулярной массы:
2KmnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5O2 + 8H2O
ЭН2О2 = МН2О2/2 = 17
Анализируемый раствор перекиси водорода количественно переносят в мерную колбу, доливают до метки водой и тщательно перемешивают. Титрование и расчет проводят так же, как при определении железа в соли Мора.
Вычисление результатов анализа:
V- Вычисление проводят, пользуясь выражением концентрации через титр по определяемому веществу.
TKmnO4/Н2О2 = 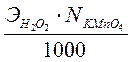
2. Рассчитывают, сколько граммов Н2О2 содержится в 5мл раствора перекиси водорода, взятой для титрования.
MН2О2 = TKmnO4/Н2О2 V1 KmnO4
V1 KmnO4 - объем раствора, пошедшего на титрование 5 мл перекиси водорода .
3. Находят количество перекиси водорода в исследуемом растворе.
PH2O2 = 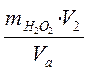
V2 - объем приготовленного раствора, мл
Vа - объем аликвоты, взятой на титрование, мл
Йодометрия.
Йодометрия основана на окислительно-восстановительных процессах, связанных с восстановлением I2 до 2I- -ионов или окислением их до I2. Свободный йод является слабым окислителем, а I- -ион – сильным восстановителем. Основная реакция при йодометрических определениях:
I2 + 2e → 2I-
Стандарный потенциал пара I2/2I- = + 0,54B. Кристаллы I2 мало растворимы в воде, поэтому их растворяют в растворе KI. При этом образуется комплексное соединение K[I3] по реакции:
I2 + I- ↔ [I3]-
Следовательно, основная реакция выражена уравнением:
[I3]- + 2e → 3I-
Метод йодометрии применяют для определения восстановителей путем окисления их раствором йода, окислителей, используя метод замещения, и сильных кислот на основе реакции:
IO3- + 5I- + 6H+ → 3I2 + 3H2O
В йодометрии применяют специфический индикатор – крахмал, весьма чувствительный к йоду, но не к йодид-ионам. В качестве стандартных растворов используют растворы йода и тиосульфата натрия (0,1; 0,05 и 0,02н растворы).
Растворы тиосульфата натрия готовят по точной навеске или из фиксанала. Хранят растворы а темных стеклянных банках. Проверку титра и нормальности тиосульфата натрия проводят не реже 1 раза в неделю.
Задания для самостоятельного выполнения:
1. К 25,00 мл раствора H2S прибавили 50,00 мл 0,01960 н раствора I2, избыток I2 оттитровали 11,00 мл 0,02040 н Na2SO3. Сколько граммов H2S содержалось в 1 литре исследуемого раствора? Ответ: 0,5150 г.
2. Определите процентное содержание сульфита натрия в техническом образце, если на навеску 0,1450г израсходовано при титровании 20,2 мл 0,1н раствора йода. Ответ: 87,7%
3. К 30 мл 0,11070н раствора KmnO4 прибавлена серная кислота и избыток иодида калия. На титрование выделившегося йода израсходовано 33,27 мл раствора тиосульфата натрия. Определить нормальность раствора тиосульфата натрия и титр его по йоду. Ответ: 0,09650н; 0,01225 г/мл.
4. Определить нормальность раствора тиосульфата натрия по раствору йода, приготовленному растворением 0,2982г в 250 мл раствора. На титрование 2,0 мл раствора тиосульфата натрия израсходовано 1,7 мл раствора йода. Ответ: 0,00798н
5. В основе определения мышьяковистого ангидрида методом йодометрии лежит реакция:
As2O3 + 2I2 + 5H2O = 2H3AsO4 + 4HI. Навеску пробы, содержащую As2O3 , массой 1,24г растворили в мерной колбе вместимостью 250мл. На окисление 25 мл полученного раствора израсходовано 24,2 мл 0,098н раствора йода. Определить процентное содержание As2O3 в пробе. Ответ 94,3%
6. На титрование йода, выделенного 2 мл хлорной воды из KI, пошло 1,5 мл 0,0106н раствора Na2S2O3. Сколько грамм хлора содержится в 1 литре хлорной воды. Ответ: 0,2796г.
7. К 10,00 мл сероводородной воды прибавлено 50,00 мл раствора йода, на избыток которого потребовалось для титрования 32,79 мл раствора тиосульфата натрия. Вычислить процентное содержание H2S в воде, если К1 = 1,1120 к 0,1н, а КNa2S2O3 = 0,9730 к 0,1н. Ответ: 0,0404%
8. Навеска, содержащая сульфит натрия 0,3878г растворена и обработана 50,00 мл раствора йода, избыток которого потребовал для обратного титрования 25,4 мл раствора Na2S2O3. T1=0,01245; TNa2S2O3 = 0,0250 г/мл. Вычислить процентное содержание Na2SO3 в образце. Ответ: 38,09%
Лабораторная работа
