Неорганическая, физическая, коллоидная химия
1. Для обработки ран, ссадин и операционного поля применяют 5-10%-ные растворы йода. Какой объем 5%-ного спиртового раствора йода можно приготовить из 10 г кристаллического йода? Плотность раствора составляет 0,950 г/мл. Массовая доля, моляльная концентрация: определение, формулы для расчета, обозначения и единицы измерения величин.
2. Вычислите массу хлорида натрия и воды, необходимые для приготовления 500 г изотонического раствора. Что является растворителем, растворенным веществом в данном растворе? Какова массовая доля хлорида натрия в гипо- и гипертотическом по отношению к плазме крови растворах? Что произойдет при помещении эритроцита в гипертонический раствор?
3. Рассчитайте буферную емкость сыворотки крови (моль/л) по кислоте, если при добавлении к 50 мл сыворотки 2 мл соляной кислоты с концентрацией 0,8 моль/л рН изменился от 7,3 до 7,0. Какую роль играют протолитические буферные растворы в организме? Перечислите кислотные буферные системы организма и укажите их состав.
4. В фармацевтической практике препарат колларгол получают в присутствии защитных коллоидов. Он представляет собой коллоидный раствор серебра, защищенный солями лизальбиновой и протальбиновой кислот. Составьте формулу мицеллы золя серебра, если роль стабилизатора играет аргентат калия AgOK. Опишите строение мицеллы. От каких факторов зависит устойчивость этого лекарственного препарата?
5. В почках функционирует аммиачный буферный раствор. Укажите его состав и рассчитайте рН буферного раствора, содержащего 3,6 мл 0,2н раствора хлорида аммония и 2,3 мл 0,1н раствора гидроксида аммония (Kb=1,74∙10-5). Какая реакция подтверждает то, что при поступлении небольшого количества сильного основания рН аммиачного буферного раствора не изменяется.
6. При определении альбумина по реакции с бромкрезоловым зеленым для создания определенной кислотности среды применяют ацетатный буферный раствор. Поясните, почему при добавлении небольшого количества сильной кислоты или сильного основания рН среды не изменяется (с помощью уравнений реакций). Вычислите рН ацетатного буферного раствора, приготовленного смешением 50 мл 0,050н раствора уксусной кислоты (Ka=1,74∙10-5) и 30 мл 0,1н раствора ацетата натрия.
7. Мицеллы слюны представляют собой пример лиофобной коллоидной частицы, агрегатом которой являются мельчайшие кристаллы малорастворимого фосфата кальция 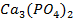 . Схематически представьте строение мицеллы, считая стабилизатором фосфат натрия. Какие факторы влияют на устойчивость коллоидной частицы? Что такое коагуляция? Сравните коагулирующее действие на вышеуказанный золь растворов хлорида натрия и хлорида кальция одинаковой концентрации.
. Схематически представьте строение мицеллы, считая стабилизатором фосфат натрия. Какие факторы влияют на устойчивость коллоидной частицы? Что такое коагуляция? Сравните коагулирующее действие на вышеуказанный золь растворов хлорида натрия и хлорида кальция одинаковой концентрации.
8. Растворы перманганата калия с массовой долей 0,01% ÷ 5% применяются в медицине в качестве антисептического средства. Определить массу растворенного вещества и массу воды, которые необходимы для приготовления 2,5 кг 5%-ного раствора KMnO4. Что такое биогенные элементы? Макро- и микроэлементы, «металлы жизни». Какие биогенные элементы являются комплексообразователями в комплексных соединениях живого организма?
9. При ацидозе в качестве экстренной меры используют внутривенное вливание растворов гидрокарбоната натрия. В острых случаях вводят до 100 мл 8,4%-ного раствора (ρ=0,90 г/мл). Сколько гидрокарбоната натрия и воды содержится в 250 мл такого раствора? Запишите уравнение реакции, показывающее механизм действия гидрокарбоната натрия. Что такое ацидоз и алкалоз?
10. Определение сроков хранения лекарственных препаратов методом «ускоренного старения лекарственной формы» основано на правиле Вант-Гоффа. Препарат выдерживают при повышенной температуре некоторое время и кинетические константы. Вычислить температурный коэффициент реакции распада пенициллина, если константы скорости реакции распада пенициллина при 36оС и 41оС равны соответственно 6∙10-6 с-1 и 1,2∙10-5 с-1. Какие факторы и каким образом влияют на скорость химической реакции?
11. Препараты, содержащие сульфат марганца (II), используются как стимуляторы гемотоза, способствуя развитию и формированию эритроцитов. Вычислить объем раствора с молярной концентрацией эквивалента 0,01 моль/л, содержащего 1,51 гMnSO4. Молярная концентрация эквивалента (определение, формулы для расчета, обозначения и единицы измерения величин).
12. При исследовании активности трансфераздинитрофенилгидразиновым методом применяют фосфатный буфер. Для его приготовления смешивают 840 мл раствора гидрофосфата натрия с концентрацией 0,1 моль/л и 160 мл раствора дигидрофосфата калия такой же концентрации. Найдите рН буферного раствора (Ka=6,16∙10-8). Что такое протолитическая буферная система? Какую роль такие системы играют в организме?
13. Угарный газ СО образует с гемоглобином прочное комплексное соединение, что является причиной его ядовитости для живого организма. Для предотвращения отравлений угарным газом необходимо проводить его полное окисление до углекислого газа. Как изменится скорость прямой реакции 2СО(г) + О2(г) ↔ ↔2CO2(г), если: а) увеличить концентрацию угарного газа в 3 раза; б) уменьшить объем системы в 5 раз? Что такое кинетическая кривая? Изобразите на графике кинетические кривые для СО и СО2.
14. Калия хлорид применяется при гипокалиемии, которая возникает при рвоте, поносах, длительном применении мочегонных средств. Рассчитать массу хлорида калия, содержащегося в 0,5 л его 0,3 М раствора. Калий является макроэлементом. Охарактеризуйте его биологическую роль. Какие элементы называются биогенными? Приведите примеры других макроэлементов.
15. Гидрокарбонатная буферная система является основной буферной системой плазмы крови. Ее буферная емкость составляет 70-80% от общей буферной емкости плазмы крови и других внеклеточных жидкостей. Приведите состав и поясните механизм действия гидрокарбонатного буферного раствора (молекулярные, полные и сокращенные ионные уравнения реакций). Какие кислотные буферные растворы есть в организме?
16. Раствор Люголя, применяющийся в лор-практике для смазывания слизистой оболочки полости рта и горла, содержит в 17 мл воды 1 г йода и 2 г иодида калия. Рассчитать массовые доли йода и иодида калия в растворе Люголя. Что такое раствор, растворитель, растворенное вещество? Охарактеризуйте биологическую роль иода.
17. При внутривенных инъекциях во избежание нарушения осмотического баланса применяются исключительно изотонические растворы. Рассчитать осмотическое давление 0,9% раствора хлорида натрия. Изотоничен ли этот раствор плазме крови? Осмотическое давление плазмы крови при 37оС составляет 760 кПа. Что такое осмос? Приведите примеры использования осмотических явлений в медицинской практике.
18. Отклонение рН крови от нормального для нее значения 7,38 всего лишь на несколько сотых долей единицы вызывает общее недомогание и заметные сдвиги в протекании различных физиологических процессов. Повышение или понижение рН крови на 0,2-0,3 единицы может привесим к коматозному состоянию, а при отклонениях порядка 0,3-0,4 единицы весьма вероятен летальный исход. Рассчитайте рН сыворотки крови, если концентрация ионов водорода составляет 4,5·10-8 моль/л. Сравните полученное значение с величиной физиологической нормы рН для сыворотки крови. Охарактеризуйте возможные состояния протолитического гомеостаза (норма, ацидоз, алкалоз).
19. Анализ белка с помощью электрофореза широко применяется в клинической биохимии с диагностическими целями. В растворе содержится два белка, изоэлектрические точки которых составляют 4,7 и 8,8. К какому электроду будут перемещаться молекулы этих белков при электрофорезе в буферном растворе с рН=7,9? Какой из указанных белков в этой среде при прочих равных условиях будет перемещаться к соответствующему электроду с большей скоростью и почему? Что такое изоэлектрическая точка раствора ВМС? Какими методами ее определяют?
20. Рассчитать осмотическое давление 0,01М раствора хлорида калия при 310 К, если изотонический коэффициент равен 1,96. Каким будет этот раствор (гипо-, гипер-, изотоническим) по отношению к плазме крови? Что будет происходить к эритроцитами в таком растворе? Осмотическое давление плазмы крови принимать равным 760 кПа. Что такое осмос, гемолиз, плазмолиз?
21. Фосфатная буферная система играет исключительно важную роль в поддержании кислотно-щелочного баланса внутриклеточных жидкостей, в которых содержание фосфатов достигает 50-70 ммоль/л. Приведите состав и поясните механизм действия фосфатного буферного раствора (молекулярные, полные и сокращенные ионные уравнения реакций). Какие компоненты включает кислотный буферный раствор? Перечислите кислотные буферные растворы организма.
22. При каком значении рН можно разделить электрофорезом два фермента А и Б с изоэлектрическими точками 5 и 8? Каковы будут знаки заряда частиц этих ферментов при рН 4, 8 и 9? Поясните, как заряжаются белковые молекулы в среде более кислой и более щелочной, чем изоэлектрическая точка. Охарактеризуйте электрокинетические свойства дисперсных систем. Приведите примеры их применения в медицине и биологии.
23. Постоянство осмотического давления (изоосмия) физиологических сред представляет собой фундаментальное физико-химическое требование гомеостаза. Осмотическое давление раствора гемоглобина в воде, содержащего 62 г гемоглобина в 500 мл раствора при 17оС, равно 3,5 кПа. Рассчитаете молярную массу гемоглобина. Дайте определения понятиям полупроницаемая мембрана, диффузия, осмос, осмотическое давление.
24. В медицинской практике применяют 10%-ный раствор аммиака (гидроксид аммония) для выведения из обморочного состояния. Рассчитать константу ионизации Kb гидроксида аммония в растворе с концентрацией 0,1 моль/л и степенью ионизации a=0,01. В каком буферном растворе содержится гидроксид аммония? Приведите его состав и укажите, где он встречается в организме.
25. АТФ и АДФ – макроэргические соединения, которые способны к отщеплению фосфатных групп с выделением большого количества энергии. При 37оС величины энтальпии и энергии Гиббса реакции гидролиза АТФ равны ∆Н0р-ции = -20 и ∆G0р-ции =-30,5 кДж/моль соответственно. Рассчитать стандартное изменение энтропии для данных условий. Экзер- и эндергонические процессы. Принцип энергетического сопряжения. Изобарно-изотермический потенциал как критерий самопроизвольного протекания биохимических реакций.
26. Растворы сульфата магния применяются в качестве вазодилатирующего (расширяющего сосуды) средства. Вычислить объем 0,02 н раствора сульфата магния, в котором содержится 18 г соли. Дайте определения понятиям: макро- и микроэлементы, органогены. Какие из них относятся к макроэлементам? Охарактеризуйте биологическую роль магния и кальция.
27. Аммиак в организме человека является одним из продуктов метаболизма аминокислот и белков, поступивших с пищей или присутствующих в клетке в качестве запасных веществ. Вычислите рН раствора гидроксида аммония с молярной концентрацией 0,00025 моль/л, если степень диссоциации α = 0,01. Сравните полученное значение с нормальным значением рН мочи, которое составляет 4,8 ÷ 7,5. Приведите состав аммиачного буферного раствора.
28. В лабораторной практике в исследовательских целях реакции могут проводиться в более широких температурных интервалах, чем это имеет место в организме человека. Температурный коэффициент биохимической реакции γ = 2,8. Рассчитайте, как изменится скорость реакции при повышении температуры на 400 С. Схема ферментативной реакции. Уравнение Михаэлиса-Ментен. Графическая зависимость скорости реакции от концентрации субстрата. Порядок ферментативной реакции при низкой и высокой концентрации субстрата.
29. В качестве химиотерапевтического противоракового препарата применяется комплексное соединение платины «Цисплатин» (диаминодихлороплатина (IV)). Напишите формулу комплексного соединения, охарактеризуйте его строение с точки зрения теории Вернера. Запишите выражения для константы нестойкости и устойчивости комплексной частицы. Что такое донорно-акцепторная связь? Поясните на примере.
30. Рассчитать осмотическое давление раствора белка с относительной молекулярной массой 10 000, если его массовая концентрация равна 1,0 кг/м3 при температуре физиологической нормы (считать молекул изодиаметричными, т.е. К=1). Что такое онкотическое давление? Что такое денатурация белка? Охарактеризуйте факторы, которые вызывают денатурацию белков.
31. Вычислить рН раствора, полученного при растворении таблетки аскорбиновой кислоты (С6Н8О6) массой 0,5 г в таком количестве воды, чтобы объем раствора достигал 0,4 л. (Ка аскорбиновай кислоты равна 8,0∙10-5)
Органическая химия
1. Дайте названия (тривиальное и по номенклатуре ИЮПАК) 20-ти α-аминокислот, входящих в состав белков.Определите кислотно-основный характер α-аминокислот.
2. На примере 20-ти α-аминокислот напишите реакцию образования трипептида, изобразите строение пептидной группы. С помощью какой универсальной реакции можно открыть присутствие α-аминокислот?С помощью какой качественной реакции можно доказать наличие пептидной связи?Например:
а) лей-про-глу (2-амино-4-метилпентановая кислота, пирролидин-2-карбоновая кислота, 2-аминопентандиовая кислота);
б) лиз-три-вал (2,6-диаминогексановая кислота; 2-амино-3-имидазолилпропановая кислота, 2-амино-3-метилбутановая кислота);
в) асп-мет-гис (аминобутандиовая кислота; 2-амино-4-метилтиобутановая кислота, 2-амино-3-имидазолилпропановая кислота);
г) иле-фен-тре (2-амино-3-метилпентановая кислота, 2-амино-3-фенилпропановая кислота, 2-амино-3-гидроксибутановая кислота),
д) вал-цис-три (2-амино-3-метилбутановая кислота, 2-амино-3-меркаптопропановая кислота, 2-амино-3-индолилпропановая кислота).
3. Напишите уравнения реакции образования внутренней соли, дезаминирования, декарбоксилирования со следующими веществами: а) лизин (2,6-диаминогексановая кислота); б) гистидин (2-амино-3-индолилпропановая кислота). Назовите продукты реакции. Отметьте кислотно-основной характер этих кислот.
4. Напишите уравнения реакции образования амида, дезаминирования, декарбоксилирования со следующими веществами: а) аспарагиновая кислота (аминоянтарная кислота); б) триптофан (α-амино-β-индолилпропионовая кислота). Назовите продукты реакции. Отметьте кислотно-основной характер этих кислот.
5. Напишите уравнения реакции окисления, образования сложных эфиров,дезаминированияна примерах: цистеина (2-амино-3-тиопропановая кислота); треонина (2-амино-3-гидроксибутановая кислота). Назовите продукты реакции. Отметьте кислотно-основной характер этих кислот.
5. Напишите таутомерные формы этилового эфира ацетоуксусной кислоты. Докажите с помощью химических реакций существование таутомерных форм этилового эфира ацетоуксусной кислоты. Напишите реакцию декарбоксилирования ацетоуксусной кислоты. При каком заболевании проводится определение в моче и крови продукта ее декарбоксилирования?
6. Напишите схему реакции получения коламина из соответствующей аминокислоты. Напишите реакции образования холина из аминокислоты серина. Напишите реакцию образования нейромедиатора – ацетилхолина. Биологическая роль.
7. Напишите производные пиридина: β–метилпиридин, никотиновая кислота, никотинамид. В состав какого кофермента входит ядро никотинамида? Какое заболевание развивается при отсутствии или недостатке витамина "РР"?С чем связана способность кофермента НАД+участвовать в окислительно-восстановительных процессах? Напишите схему его участия.
8. Пиримидиновые основания: урацил, тимин, цитозин. Лактам-лактимная таутомерия.
9. Пуриновые основания: аденин, гуанин. Лактим-лактамная таутомерия.
10. Нуклеотиды. Строение АМФ (аденозин-5/-монофосфат),ГМФ (гуанозин-5/-монофосфат), ТМФ(тимидин-5/-монофосфат),ЦМФ (цитидин-5/-монофосфат),УМФ (уридин-5/-монофосфат),АТФ (аденозин-5/-трифосфат). Назовите типы связи, биологическая роль.
11. Циклические формы нуклеотидов. Циклическая АМФ, ГМФ, биологическая роль.
12. Отношение нуклеотидов к гидролизу. Кислотный и щелочной гидролиз. Назовите продукты реакции гидролиза. Отметьте различия N – гликозидной, сложно – эфирной связей в реакциях гидролиза.
13. Моносахариды: глюкоза, галактоза,манноза, рибоза, дезоксирибоза, фруктоза. Энантиомеры, диастереомеры.Классификация и цикло-оксо- таутомерия моносахаридов (Формулы Фишера, Хеуорса).
14. Образование гликозидов и сложных эфиров, образованных уксусной и фосфорной кислотами. Напишите реакции образования сложных эфиров b-D-рибофуранозы и b-D-фруктофуранозы с фосфорной кислотой.
15. Получение –оновых, -аровых и -уроновых кислот. Написать реакцию окисления галактозы до галактуроновой кислоты с последующим декарбоксилированием.
16. Реакция гидрирования маннозы. Реакция восстановление фруктозы.
17. Дисахариды. Строение мальтозы, лактозы. Назовите исходные моносахариды и образующиеся в результате реакции гликозидную связь. Цикло-оксо-таутомерия. Реакция гидролиза. Обладают ли мальтоза и лактоза восстанавливающими свойствами?
18. Сахароза. Строение. Какую конфигурацию имеют аномерные атомы углерода в остатках D-фруктозы и D-глюкозы? Объясните почему сахароза не способна к цикло-оксо-таутомерии?
19. С помощью какой реакции можно отличить сахарозу от фруктозы. Приведите схему реакции.
20. Сходство и различие сахарозы, мальтозы в реакциях: 1) Фелинга; 2) образования гликозидов; 3) образования простых и сложных эфиров?
21. Заменимые и незаменимые высшие жирные кислоты. Строение.
22. Дайте определение йодному числу. Напишите реакции образования 1) 1-олеодипальмитина; 2) 1,2 –диолеопальмитина. У какого из этих жиров больше йодное число? Почему? Какой реакцией можно определить содержат ли данные липиды ненасыщенные соединения.
23. Напишите структурную формулу1,2-диолеостеарина и определите консистенцию жира.
24. Напишите реакцию образования 1-линолеодистеарина в кислой среде.
25. Напишите схему реакции щелочного гидролиза (омыления) 1-олеоил-2-пальмитоил-3-стеароилглицерола.
26. Кислотный гидролиз 1-пальмитоил-2-линоленоилфосфатидилэтаноламина.
27. Схема реакции кислотного гидролиза фосфатидилхолина, содержащего остатки пальмитиновой и арахидоновой кислот.
28. Реакция щелочного гидролиза 1-пальмитоил-2-олеоилфосфатидилсерина.
29. Напишите и назовите реакции, доказывающие генетическую связь между азотосодержащими веществами, входящими в состав фосфоглицеридов.
30. Производные холана (желчные кислоты). Приведите схемы реакций взаимодействия холевой кислоты с таурином и глицином. Биологическое значение холевой, гликохолевой и таурохолевой кислот.
Приложение
