Классификация комплексных соединений
(По типу координируемых лигандов)
Аквакомплексы – это комплексные катионы, в которых лигандами являются молекулы H2O. Их образуют катионы металлов со степенью окисления +2 и больше, причем способность к образованию аквакомплексов у металлов одной группы периодической системы уменьшается сверху вниз.[Cu(H2O)6]Cl3
Гидроксокомплексы – это комплексные анионы, в которых лигандами являются гидроксид-ионы OH–. Комплексообразователями являются металлы, склонные к проявлению амфотерных свойств – Be, Zn, Al, Cr.Na2[Zn(OH)4]
Аммиакаты – это комплексные катионы, в которых лигандами являются молекулы NH3. Комплексообразователями являются d-элементы.[Cr(NH3)6Cl3
Ацидокомплексы – это комплексные анионы, в которых лигандами являются анионы неорганических и органических кислот.K4[Fe(ON)6]
(По принадлежности к опред.классу соединений.)
Комплексные кислоты H2[SiF6]
Комплексные основания [Ag(NH3)2]OH
Комплексные соли K2[HgJ4]
(По знаку заряда комплекса)
Катионные комплексы [Zn(H2O)4]+2Cl2
Анионные Na2[Zn(OH)4]2-
Нейтральные Co(NH3)3CL3]0
45.Номенклатура к.с.Название комплексного аниона начинают с названия состава внут. сф.,в кот.сначала наз-ют лиганды-анионы, прибавляя к их лат.наз-ию «о».Затем лиганды-нейтральные.мол-лы.Cl—хлоро,SO42—сульфато,OH--гидроксо,CN-- циано,NH3- аммин,H2O-аква,CO-карбонил.Число лигандов указывают гречес.числительными(2-ди,3-три,4-тетра,5-пента,6-гекса). Затем называют комплексообразователь ,добавляя «ат».в скобках римск.цифрами указ-ют его с.о. после наз-ие катионов внеш.сф. K[Fe(NH3)2(CN)4]-тетрацианодиамминферрат(III) калия.Если в к.с. входит комп-ый катион,то название начинают с внеш.сф. далее лиганды, компл-ль,используя его русское наз-ие и с указ-ем его с.о. [Pt(NH3)4Cl2]Cl2-хлорид дихлоротетраам- минплатины(IV).Если нейтральный комплекс,то с.о. компл-ля не приводят. [Co(H2O)3(NO2)2Cl]-хлородинитритотри- аквакобальт.
46.Устойчивость к.с. в растворах.Внутр. и внеш.сф.комплексеого соединения сильно отличаются по устойчивости.Частицы,находящиеся во внеш сф.связаны с комплексом ионной связью и легко отделяются в р-ре.Эта диссоциация- первичная.[Ag(NH3)2]Cl→[Ag(NH3)2]++Cl- Лиганды,наход.во внут.сф.связаны с комп- лексообразователем ковалентной связью и отщипляются в р-ре в очень маленькой степени.Диссоциация вторичная.[Ag(NH3)2]+↔Ag++2NH3 Кравн=Кнестойкости= 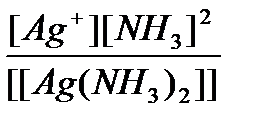 Кнест- мера прочности комплекса,чем она <,тем более устойчив комплекс.
Кнест- мера прочности комплекса,чем она <,тем более устойчив комплекс.
47.Металлы,способы пол-ия.Металлы-это эл-ты, атомы кот.имеют мало электронов на внеш.энерг.ур.(1-3).К Ме относят:s,d,f-эл-ты и некоторые р. Al,Sn,Pb,Bi-р эл-ты.Неактив-ые Ме наход. в природе в свободном самородном сост. (Au,Ir,Pt,режеAg,Cu).Щелочн./щелочно земельные Ме наход.в природе в виде солей: хлориды:NaCl,KCl,MgCl2 и CaCO3,BaSO4. Ме средней активности наход.в виде оксидов/ сульфидов:Al2O3,Fe3O4,PbS,HgS,FeS2. Способы получения Ме:1)пирометаллургия- это процесс восстановления оксидов в безводных условиях при высоких t с помощью угля С(СО), Н2 и др.активных Ме.
2)гидрометаллургия-способ извлечения Ме и помощью водных р-ров.
3)электрометаллургия-получ.Ме с помощ. Электролиза расплава солей.Пол-ют щелоч./щелоч.зем.Ме и Mg,Al.
48.Механизм возникновения потенциала на границе Металл-растворСтандартные электродные потенциалы.Уравнения Нериста. Если погрузить пластинку активного Ме в воду, то начинается взаимод.ионов Ме с полярными молекулами воды,ориентированнымиу поверхности Ме.В рез-те взаимод.происх.окисление Ме и его гидратированные ионы переходят в р-р,оставляя в Ме электроны, заряд кот.не скомпенсирован полож.заряженными ионами,оставшимеся в Ме:
Ме становится заряженным отриц.,а р-р-«+». «+» заряженные ионы из р-ра притягива- ются к «-« заряж.поверхности Ме.На границе Металл-раствор возник.двойной электр.слой.Между Ме и р-ром возник.разность потенциалов-электродный потенциал.На величину электродного потенциала φ влияют: природа Ме,активность ионов Ме,t.Эта зависимость выражается ур.Нериста. φ=φ0+RT/nF∙Ina, φ-электр.пот-л Ме,В; φ0- стандартный электр.пот. при активности иона Ме=1моль/л,В;R-универс-я газ-вая постоянная=8,316 Дж/(К∙моль);Т-темп,К; n-заряд иона Ме;F-постоянная Фарадея= 96487Кл;а-активность ионов Ме в р-ре,моль/л.Если t=250С,то φ=φ0+0,059/n∙lga
Методом эксперементального опред.разности потенциалов(∆φ)в сист.Металл-раствор не сущ.Но можно опред.относительную величину.Для этого нужно составить гальванический элемент из исследуемого Ме и электрода сравнения и измерить ЭДС такого эл-та.Элект- рода сравнения исп.водородный электрод, потенциал кот.=0.
49.Электрохимический ряд напряжений металлов.По величине стандартного электродного потенциала в порядке его↑ все Ме распол.в ряд стандарных электронов \ или просто ряд активности.На основании ряда активности можно сделать выводы:1)чем ниже знач.φ0, тем более сильным восст-лем явл.Ме,и тем более слабым окис-лем явл.соответствующий. ион Ме.Чем↑знач.φ0.тем слабее вост-лем Ме и сильнее окисл-лем ион Ме.K,Na- самые сильные вос-ли,Na+-слабый ион, Cu,Ag-слабые вос-ли,Сu2+-сил.ион.2)Каждый Ме в ряду активности вытесняет все последующие. за нимМе из водных р-ров их солей. Zn+CuSO4=ZnSO4+Cu;Cu+ZnSO4≠ 3)Ме,стоящие до Н могут вытеснять Н из разбавленной кислоты.,анионы кот.не проявл.окислит. свойства.Zn+2HCl=ZnCl2+H2;Cu+HCl≠.4)чем> разность стандартных электродных потенциалов у 2-х Ме,тем >ЭДС будет у гальванического элемента одного из них.
50. Химические свойства металлов: отношение к воде, кислотам, щелочам, солям, неметаллам.Металлы являются сильными восстановителями, взаимодействуют с различными окислителями.
1. вода.Металлы, стоящие в электрохимическом ряду стандартных электродных потенциалов до магния, являются активными и легко вытесняют водород из воды.
Металлы от магния по железо включительно (имеющие стандартный электродный потенциал меньше -0,42 В) являются менее активными и с водой могут взаимодействовать при условии разрушения на их поверхности защитных пленок.
2. кислоты.Металлы стоящие в ряду активности до водорода способны вытеснять водород из разбавленныз кислот, анионы которых не проявляют окислительные свойства.
3. щелочи.В щелочах растворяются металлы оксиды и гидроксиды которых амфотерны(AL,Zn,Sn,Be,Pb)
4. соли.Каждый металл в ряду активности вытесняет все последующие за ним металлы из водных растворов их солей.
5. неметаллы.
51. Гальванические элементы: Даниэля-Якоби, Вольта, концентрационные гальванические элементы. Принцип действия, анодные и катодные процессы.
Даниэля-Якоби – медно-цинковый гальванический элемент. Состоит из Си и Zn электродов. которые погружены в растворы CuSO4 и ZnSO4 соотв.ZnSO4=Zn2++SO42-,CuSO4=Cu2++SO42-,A(-)Zn0-2e=Zn2+,K(+) Cu2++2e=Cu0
Вольта - первичный элемент, у к-рого положит. электрод - медная пластина, отрицат. - цинковая, электролит - р-р хлорида натрия или серной к-ты.(H2SO4=2H++SO42-,A(-)Zn0-2e=Zn2+,K(+) 2H+2e=H2.
Концентрационный - электроды и электролит - одинаковой природы. Напряжение в гальваническом элементе возникает за счет разности концентраций электролитов в обеих полуэлементах.
Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока.
Катодные продукты:
1) Если металл стоит до алюминия (включительно) в Электрохимическом Ряду, то на катоде выделяется водород.
2) Если металл стоит после алюминия до водорода в ЭР, то на катоде выделяется и металл, и водород.
3) Если металл стоит после водорода в ЭР, то на катоде выделяется металл.
Анодные продукты:
1) Если кисл. остаток не содержит кислород (исключение: фториды), то на аноде выделяются анион кисл. остатка.
2) Если кисл. остаток содержит кислород или если это фторид, то на аноде выделяется гидроксид анионы с образованием O2.
