Примеры решений типовых задач
Пример 1. Вычислите заряды комплексных ионов , образованных платиной (IV): 1) [ 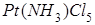 ]; 2) [
]; 2) [ 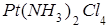 ]; 3) [
]; 3) [ 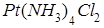 ]. Назовите эти соединения.
]. Назовите эти соединения.
Решение.Степень окисления атома платины (комплексообразователя) равна +4, заряд молекулы аммиака (лиганда) равен нулю, а заряд хлорид-аниона (другого лиганда) равен -1; в итоге в соединении 1) - пентахлорамминплатине (IV) ([ 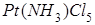 ]
] 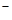 ) - суммарный заряд составляет +4 + (-5) = -1.
) - суммарный заряд составляет +4 + (-5) = -1.
Аналогичным образом находим заряды других комплексов:
2) в тетрахлордиамминплатине (IV) ([ 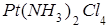 ]) +4 + (-4) = 0,
]) +4 + (-4) = 0,
3) в дихлортетраамминплатине (IV) ([ 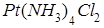 ]
] 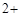 ) +4 + (-2) = +2.
) +4 + (-2) = +2.
В первом случае внешняя сфера содержит катионы, во втором – соединение является неэлектролитом, а в третьем – внешнюю сферу содержит анионы.
Пример 2.В результате приливания раствора 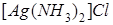 к раствору тиосульфата калия
к раствору тиосульфата калия 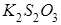 образуется комплексная соль
образуется комплексная соль 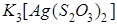 . Составьте уравнение реакции и укажите причину её протекания.
. Составьте уравнение реакции и укажите причину её протекания.
Решение:Учтём, что прочность аммиачных комплексов значительно ниже, чем тиосульфатных: это видно из сравнения соответствующих констант нестойкости (см. табл. 3 Приложения). Реакция всегда протекает в направлении образования более прочного комплексного иона. В рассматриваемом случае уравнение реакции в молекулярной форме имеет следующий вид:
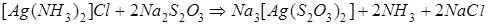 ,
,
В полной ионно-молекулярной форме это уравнение записывается так:
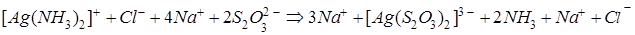 .
.
Принимая во внимание, что ионы 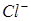 и
и 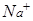 практически не изменяют своей концентрации в растворе, окончательно имеем:
практически не изменяют своей концентрации в растворе, окончательно имеем:
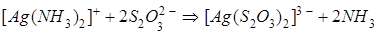 .
.
Пример 3. Константа нестойкости иона 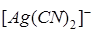 составляет
составляет 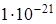 . Вычислить концентрацию ионов серебра в 0,05 M растворе
. Вычислить концентрацию ионов серебра в 0,05 M растворе 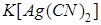 , содержащем, кроме того, 0,01 моль/л
, содержащем, кроме того, 0,01 моль/л 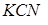 .
.
Решение. Вторичная диссоциациякомплексного иона протекает по уравнению:
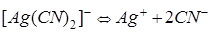 .
.
В присутствии избытка ионов 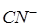 , создаваемого в результате диссоциации
, создаваемого в результате диссоциации 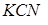 (которую можно считать полной), это равновесие смещено влево настолько, что количеством ионов
(которую можно считать полной), это равновесие смещено влево настолько, что количеством ионов 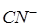 , образующихся при вторичной диссоциации, можно пренебречь. Тогда
, образующихся при вторичной диссоциации, можно пренебречь. Тогда 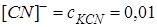 моль/л. По той же причине равновесная концентрация ионов
моль/л. По той же причине равновесная концентрация ионов 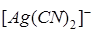 может быть приравнена общей концентрации комплексной соли (0,05 моль/л).
может быть приравнена общей концентрации комплексной соли (0,05 моль/л).
По условию задачи:
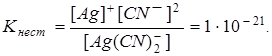
В итоге определим концентрацию ионов 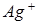 :
:
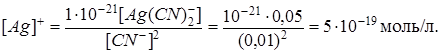
Пример 4. Растворы простых солей кадмия образуют с щелочами осадок гидроксида кадмия 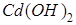 , а с сероводородом – осадок сульфида кадмия CdS. Чем объяснить, что при добавлении щёлочи к 0,05 M раствору
, а с сероводородом – осадок сульфида кадмия CdS. Чем объяснить, что при добавлении щёлочи к 0,05 M раствору 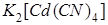 , содержащему 0,1 моль/л KCN, осадок не образуется, тогда как при пропускании через этот раствор сероводорода выпадает осадок CdS ? Константу нестойкости иона
, содержащему 0,1 моль/л KCN, осадок не образуется, тогда как при пропускании через этот раствор сероводорода выпадает осадок CdS ? Константу нестойкости иона 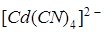 принять равной
принять равной 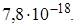
Решение.Из условий образования осадков 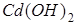 и CdS следует:
и CdS следует:
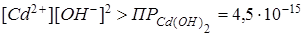 ,
,
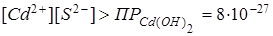 .
.
Учтём, что в растворе комплексной соли концентрацию ионов 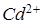 можно аппроксимировать уравнением (см. пример 3):
можно аппроксимировать уравнением (см. пример 3):
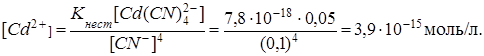
Концентрация ионов 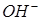 , достаточная для осаждения гидроксида кадмия, может быть определена из неравенства:
, достаточная для осаждения гидроксида кадмия, может быть определена из неравенства:
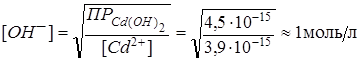 .
.
Следовательно, в рассматриваемой системе при концентрациях ионов 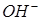 меньших, чем 1
меньших, чем 1 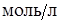 , равновесие
, равновесие 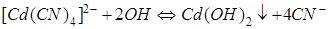 смещено в сторону образования комплексного иона.
смещено в сторону образования комплексного иона.
Условие образования осадка сульфида кадмия из заданного раствора тетрацианокадмата калия отражает неравенство:
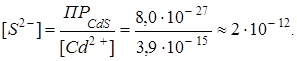
Таким образом, даже при малых концентрациях сульфид-иона равновесие 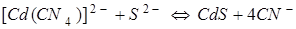 практически полностью смещено в сторону образования сульфида кадмия.
практически полностью смещено в сторону образования сульфида кадмия.
