Свойства элементов подгруппы углерода
| Свойства | С | Si | Ge | Sn | Pb |
| 1. Порядковый номер | |||||
| 2. Валентные электроны | 2s22p2 | 3s23р2 | 4s24р2 | 5s25р2 | 6s26р2 |
| 3. Энергия ионизации атома, эВ | 11,3 | 8,2 | 7,9 | 7,3 | 7,4 |
| 4. Относительная электроотрицательность | 2,50 | 1,74 | 2,02 | 1,72 | 1,55 |
| 5. Степень окисления в соединениях | +4, +2, -4 | +4, +2, -4 | +4, -4 | +4, +2, -4 | +4, +2, -4 |
| 6. Радиус атома, нм | 0,077 | 0,134 | 0,139 | 0,158 | 0,175 |
Элементы подгруппы углерода образуют оксиды общей формулы RO2 и RO, а водородные соединения - формулы RН4.Гидраты высших оксидов углерода и кремния обладают кислотными свойствами, гидраты остальных элементов амфотерны, причем кислотные свойства сильнее выражены у гидратов германия, а основные - у гидратов свинца. От углерода к свинцу уменьшается прочность водородных соединений RН4: СН4 - прочное вещество, а PbH4в свободном виде не выделено. В подгруппе с ростом порядкового номера уменьшается энергия ионизации атома и увеличивается атомный радиус, т. е.неметаллические свойства ослабевают, а металлические усиливаются.
Химические свойства углерода и кремния. Графит и кремний — типичные восстановители . При нагревании с избытком воздуха графит (именно этот аллотроп наиболее доступен)и кремний образуют диоксиды:
С + О2 = СО2,
Si + О2 = SiO2,
при недостатке кислорода можно получить монооксиды CO или SiO:
2С + О2 = 2СО,
2Si + O2 = 2SiO,
которые образуются также при нагревании простых веществ с их диоксидами:
С + СО2 = 2СО,
Si + SiO2 = 2SiO.
Уже при обычной температуре углерод и кремний реагируют со фтором, образуя тетрафториды СF4 и SiF4, при нагревании — с хлором, давая СCl4 и SiCl4.При более сильном нагревании углерод и кремний реагируют с серой и азотом:
4С + S8 = 4СS2,
2С + N2 = С2N2,
4Si + S8 = 4SiS2
и даже между собой, образуя карборунд — вещество, по твердости близкое к алмазу:
Si + С = SiC.
Обычные кислоты на углерод и кремний не действуют, тогда как концентрированные Н2SО4 и НNО3 окисляют углерод:
С + 2Н2SО4 = СО2↑+ 2SО2↑ + 2Н2О,
3С + 4НNO3 = 3СО2↑ + 4NO↑ +2Н2О.
Кремний растворяется в смеси концентрированных азотной и плавиковой кислот:
3Si + 4НNО3 + 12НF = 3SiF4↑ + 4NO↑ +8Н2О.
Кроме того, кремний растворяется в водных растворах щелочей:
Si + 2NaОН + Н2О = Na2SiO3 + Н2↑.
Графит часто используют для восстановления малоактивных металлов из их оксидов:
СuО + С = Сu + СО↑.
При нагревании же с оксидами активных металлов углерод и кремний диспропорционируют, образуя карбиды
СаО + 3С = СаС2 + СО↑,
2Аl2О3 + 9С = Аl4С3 + 6СО↑
или силициды
2МgО + 3Si = Мg2Si + 2SiO.
Активные металлы — более сильные восстановители, чем углерод или кремний, поэтому последние при непосредственном взаимодействии с ними выступают в качестве окислителей
Са + 2С = СаС2,
2Mg + Si = Мg2Si.
· Кислородные соединения
Оксид углерода (II) и оксид кремния (II)
Оба оксида получают неполным окислением простых веществ или по реакциям: С + СО2 = 2СО, Si + SiO2 = 2SiO. Они оба не реагируют при обычных условиях ни с кислотами, ни со щелочами. Оксид кремния (II) мало доступен и очень редко используется, в отличие от угарного газа СО, на свойствах которого мы остановимся ниже.
Оксид углерода (II) – ядовитый газ без цвета и запаха, горит голубоватым пламенем, легче воздуха, температура кипения 81,63 К, температура плавления 68,03 К, плохо растворим в воде (2,3 объема СО на 100 объемов H2O при 293 К).
Оксид СО принято считать несолеобразующим, однако при пропускании его в расплав щелочи при высоком давлении непосредственно образуется соль в результате протекания окислительно-восстановительной реакции:
СО + КОН = НСООК.
Отсюда формально можно считать СО ангидридом муравьиной кислоты, что подтверждается обезвоживанием муравьиной кислоты:
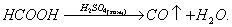 (*)
(*)
Следует, однако, обратить внимание, что в рассмотренных выше реакциях меняется степень окисления углерода +4 в муравьиной кислоте и в ее соли и +2 - в оксиде углерода(II) и эти реакции являются фактически окислительно-восстановительными. В то время как в реакциях соединения, характерных для "классических" солеобразующих оксидов, степень окисления элементов никогда не меняется, например:
СаО + СО2 = СаСО3.
Формальная степень окисления углерода +2 не отражает строение молекулы СО, в которой помимо двойной связи, образованной обобществлением электронов С и О, имеется дополнительная, образованная по донорно-акцепторному механизму за счет неподеленной пары электронов кислорода (изображена стрелкой):
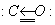
В связи с этим молекула СО очень прочна и способна вступать в реакции окисления-восстановления только при высоких температурах. При обычных условиях СО не взаимодействует с водой, щелочами или кислотами.
На воздухе СО горит голубоватым пламенем:
2СО + O2 = 2СO2 .
При нагревании он восстанавливает металлы из их оксидов:
FеО + СО = Fе + СО2↑.
В присутствии катализатора или под действием облучения СО окисляется хлором, образуя ядовитый газ фосген:
СО + Сl2 = СОСl2.
При взаимодействии с парами воды идет обратимая реакция с образованием СО2 и водорода:
СО + Н2О 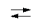 СО2 + Н2,
СО2 + Н2,
при нагревании с водородом при повышенном давлении образуется метиловый спирт:
СО + 2Н2 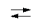 СН3ОН.
СН3ОН.
Со многими металлами СО образует летучие карбонилы:
Ni + 4СО = Ni(СО)4 .
В природе оксид углерода (II) практически не встречается. В лаборатории его обычно получают обезвоживанием муравьиной кислоты по реакции (*).
Оксид углерода (II) может быть также получен при восстановлении оксида углерода (IV) углеродом или металлами:
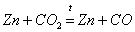
Оксид углерода (IV), Угольная кислота и ее соли
Оксид углерода (IV) (диоксид углерода, углекислый газ) - газ без цвета и запаха, не поддерживающий дыхания и горения, тяжелее воздуха. Он растворим в воде (88 объемов СО2 в 100 объемах Н2О при 20°С). При обычных давлениях твердый диоксид углерода переходит в газообразное состояние (сублимируется), минуя жидкое состояние. При обычной температуре под давлением 60 атм переходит в жидкость.
При большой концентрации оксида углерода (IV) люди и животные задыхаются. При его концентрации в воздухе до 3% у человека наблюдается учащенное дыхание, более 10% - потеря сознания и даже смерть.
Оксид углерода (IV) является ангидридом угольной кислоты Н2СО3 и обладает всеми свойствами кислотных оксидов.
При растворении СО2 в воде частично образуется угольная кислота, при этом в растворе существует следующее равновесие:
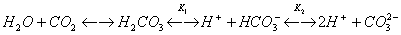
Существование равновесия объясняется тем, что угольная кислота является очень слабой кислотой (K1 = 4∙10-7, К2 = 5∙10-11 при 25 °С). Даже такая слабая кислота, как уксусная, намного сильнее угольной. В свободном виде угольная кислота неизвестна, так как она неустойчива и легко разлагается. Как двухосновная кислота она образует средние соли -карбонаты и кислые - гидрокарбонаты. Качественная реакция на эти соли - действие на них сильных кислот, при котором кислота вытесняется и разлагается с выделением СО2:
СО32-+ 2Н+  Н2СО3
Н2СО3  Н2О + СО2↑,
Н2О + СО2↑,
НСО3- + Н+ 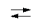 Н2СО3
Н2СО3 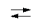 Н2О + СО2↑.
Н2О + СО2↑.
При пропускании выделяющегося СО2 в известковую воду выпадает белый нерастворимый осадок; этой реакцией пользуются также для обнаружения оксида углерода (IV):
Са(ОН)2 + СО2 = СаСО3↓ + Н2О.
Из всех карбонатов в воде растворимы карбонаты только щелочных металлов и аммония. Гидрокарбонаты большинства металлов хорошо растворимы в воде.
Под действием избытка оксида углерода (IV) нерастворимые в воде карбонаты превращаются в растворимые гидрокарбонаты:
| СаСО3 | + | H2O | + | CO2 | = | Са(НСО3)2 |
| взвесь в воде | избыток |
Гидрокарбонаты при нагревании распадаются на карбонаты, углекислый газ и воду:
2NаНСО3 = Nа2СО3 + Н2О + СО2↑.
Все карбонаты, кроме карбонатов щелочных металлов, при нагревании разлагаются на оксид металла и диоксид углерода:
МgСО3 = МgО + СО2↑.
Из солей угольной кислоты наибольшее практическое значение имеет сода; известны различные кристаллогидраты соды Nа2СО3∙10Н2О, Nа2СО3.7Н2О или Na2СО3.Н2О; наиболее устойчивым кристаллогидратом является Nа2СО3.10Н2О, который обычно называют кристаллической содой. При прокаливании получают безводную, иликальцинированную соду Nа2СО3. Широко используется также питьевая сода NаНСО3. Из других солей важное значение имеют К2СО3 и СаСО3.
Основные количества соды получают получают по аммиачному способу, часто его называют также методом Сольвэ.
Суть метода заключается в насыщении концентрированного раствора поваренной соли (точнее, насыщенного раствора NаСl) аммиаком при охлаждении и последующем пропускании через этот раствор СО2 под давлением. При этом идут следующие реакции:
NН3 + СО2 + Н2О = NН4НСО3,
NН4НСО3 + NаСl = NаНСО3↓ + NН4Сl.
Питьевая сода NaНСО3 - нерастворима в холодном насыщенном растворе и ее отделяют фильтрованием. При прокаливании NаНСО3 получают кальцинированную соду; выделяющийся при этом СО2 вновь используют в производстве:
2NаНСО3 = Na2СО3 + СО3 + Н2О.
Нагревая раствор, содержащий хлорид аммония с известью, выделяют обратно аммиак:
2NН4Сl + Са(ОН)2 = 2NН3 + СаСl2 + 2Н2О.
Таким образом, при аммиачном способе получения соды единственным «отходом» является хлорид кальция, остающийся в растворе и имеющий ограниченное применение.
Поташ К2СО3 нельзя получить по методу Сольвэ, так как он основан на малой растворимости кислой соли NаНСO3 в насыщенном растворе, тогда как КНСО3 (в отличие отNаНСО3) хорошо растворим в таких растворах. Реакция
КСl + NН4НСО3 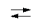 КНСО3 + NН4Сl
КНСО3 + NН4Сl
будет полностью обратимой (ни один из продуктов не удается выделить из сферы реакции в индивидуальном виде). Поэтому карбонат калия получают действием СО2 на раствор едкого калия:
КОН + СО2 = КНСО3,
КНСО3 + КОН = К2СО3 + Н2О.
Производство соды является одним из крупнейших среди производств неорганических веществ; в настоящее время ее мировое производство составляет десятки млн. тонн.
