С помощью н-катионита марки ку-2
Принцип умягчения воды довольно прост: жесткую воду пропускают через колонку с катионитом, периодически отбирают пробы умягченной воды и качественной реакцией с Na2CO3 определяют наличие в ней ионов
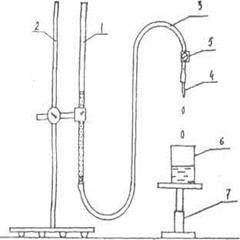
Са2+ и Mg2+ (по появлению мути). Как только очередная проба подтверждает наличие в воде ионов Са2+ и Mg2+ , это означает, что обменная емкость катионита исчерпана, он больше не связывает ионы. На основании экспериментально измеренного объема воды, пропущенной через катионит, объема катионита и известной жесткости воды рассчитывают обменную емкость катионита в мэкв/см3 сухого катионита. Установка изображена на рис. 2.
| Рис. 2. Установка для определения жесткости воды. 1 - колонка с катионитом; 2.- штатив; 3- соединительная хлорвиниловая трубка; 4- пипетка; 5 - зажим; 6 - стаканчик для сбора жидкости; 7 - подставка |
 |
Порядок выполнения работы
1. Отмерить цилиндром в колбу 600 мл жесткой воды.
2. Заполнить водой бюретку с катионитом таким образом, чтобы
уровень воды в бюретке совпадал с уровнем воды в пипетке. При заполнении следить за тем, чтобы в соединительной трубке и пипетке не было пузырьков воздуха. В случае их образования открыть зажим 5 и выпустить
воздух.
3. Приготовить семь стаканчиков емкостью 100 мл.
4. Пропустить воду через колонку с катионитом со скоростью 15 мл
в минуту и собрать в стаканчики по 60 мл (до метки). Первую пробу вы
лить, но объем воды принять в расчет.
5. Из каждого стаканчика отобрать пипеткой по 10 мл умягченной
воды и перенести в пробирки.
6. В каждую из пробирок добавить по 5 мл 20% раствора Na2CO3
(соды) и наблюдать за появлением помутнения в течение двух минут.
7. Первую пробирку, в которой произошло помутнение, отмечают и
проводят в соответствующей пробе анализ общей жесткости воды описанным выше методом.
8. Обменную емкость сухого катионита рассчитывают по формуле:
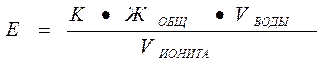
где К - коэффициент набухания ионита. Принять равным 1,8;
Жобщ - общая жесткость воды;
V 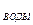 - объем воды, равный:
- объем воды, равный:
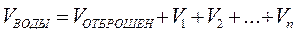 ,
,
n - число проб до появления помутнения;
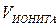 -объем ионита, рассчитываемый по формуле:
-объем ионита, рассчитываемый по формуле:
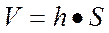 или
или 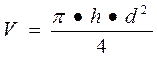
где h - высота столба катионита в колонке,
d - внутренний диаметр колонки.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Что такое временная и постоянная жесткость воды?
2. Какими способами можно устранить карбонатную жесткость воды? Приведите уравнения реакций.
3. Как можно устранить некарбонатную жесткость воды? Приведите
уравнения реакций.
4. Что такое иониты? Как с их помощью можно обессолить воду?
Напишите соответствующие уравнения реакций.
5. Жесткость воды, содержащей толькогидрокарбонат кальция, равна 1,8 мэкв/л. Определите массу гидрокарбоната в 1 л воды.
6. Сколько граммов гашеной извести Са(ОН2) необходимо прибавить к 1 м3 воды, чтобы устранить временную жесткость, равную 2 мэкв/л?
7. Сколько граммов сульфата кальция CaSO4 содержится в 1 м3 во
ды, если жесткость, обусловленная присутствием этой соли, равна
4 мэкв/л.
8. При кипячении 250 мл воды, содержащей гидрокарбонат кальция
Са(ИСО3)2, выпал осадок массой 3,5 мг. Чему равна жесткость воды?
9. В 100 л воды содержится 1,5 моля гидрокарбоната кальция и
0.1 моля хлорида магния. Какова общая жесткость воды?
ЛИТЕРАТУРА
Глинка Н.А. Общая химия. Л.: Химия, 1984. 702 с.
Курс общей химии / Под ред. Н.В. Коровина. М.: Высшая школа, 1991.
343 с.
Глинка Н.Л. Задачи и упражнения по общей химии. М.: 1994. 234 с.
Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. М.: Химия,
1990 г. 480 с.
Фейзиев Г.К. Высокоэффективные методы умягчения, опреснения и
обессоливания воды. М.: Энергоиздат. 1988 г. 192 с, ил.
