Ерітіндіді түзілгенде молекулалар арасындағы әрекеттесу күштер өзгереді
Ерітіндідегі бөлшектердің саны өзгереді.
Pi= P0ixi
X1=Pi/P0i
X2=∆P/P0i
Ерітінді деп еріген заттар мен олардан түзілген химиялық қосылыстар арсында тепе теңдік орнайтын жүйені айтады
Химиялық кинетиканың негізгі түсініктері: жылдамдық константасы, реті, молекулалығы. Әр түрлі ретті қайтымсыз реакциялардың кинетикасы. Химиялық реакция деп бір немесе бірнеше заттың химиялық өзгеріске ұшырап бір немесе бірнеше жаңа заттарға айналуын айтамыз.Көп жағдайларда химиялық реакция нәтижесінде бастапқы заттар молекулаларынан реакция өнімі түзілуі тікелей бір сатымен бірнеше сатылармен өтеді.Химиялық реакция сатыларының жыйынтығын реакцияның механизмі д.а.Реакцияның термодинамикалық қасиеттері-энтальпия,энтропия,Гиббс энергиясының өзгерістері реакцияның жүру жолдарына байланысты емес.Бір ғана фазада өтетін химиялық реакцияны гомогенді реакция дейді.Екі немесе одан да көп фазалардың фазааралық шекарасында өтетін реакцияны гетерогенді реакция деп атайды.Кейбір сатылары гомогенді жағдайда,ал басқалары гетерогенді жағдайда өтетін күрделі химиялық реакцияны гомогенді-гетерогенді реакция д.а.Мысалы ерітіндіде өтетін гомогенді реакцияларға жатады,ал гетерогенді реакциялар ретінде қатты катализатор бетінде жүретін катализдік процестерді жатқызуға болады.
Бастапқы алынға заттар мен реакция нәтижесінде шыққан өнімдердің бір фазада немесе әр түрлі фазада болуына байланысты химиялық просестерді гомофазалы және гетерофазалы деп бөлеміз. Геторегенді-гомофазалы процеске мысал ретінде:
С2H4+H2 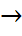 C2H6
C2H6
CaCO3+2HCl 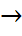 CaCl2+CO2
CaCl2+CO2 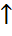 +H2O
+H2O
Түзілу реакциялары жатады.
Химиялық реакцияның өту жағдайлары (температура,қысым,реакция өтетін орта)тұрақты болған кезде реакция жылдамдығы тек әрекеттесуші заттардың концентратциясына тәуелді болады.Химиялық реакцияның жылдамдығы әрекеттесуші заттардың концентратцияларының көбейтіндісіне тура пропорционал болады.Әдетте температура өскен сайын химиялық реакциялардың жылдамдығы артады.Температура өскенде реакция жылдамдығының кемуі өте сирек кездеседі.Осындай сирек кездесетін реакцияға азот оксидінің оттегімен тотығуы жатады:2NO+O2 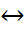 2NO2.Бұл реакцияның жылдамдығы кинетиканың негізгі заңы бойынша мына формуламен анықталады:
2NO2.Бұл реакцияның жылдамдығы кинетиканың негізгі заңы бойынша мына формуламен анықталады:  =k
=k  .
.
Мұндағы n1,n2-концентрациялардың дәреже көрсеткіштері.Бұл теңдеудегі пропорционалдық коэффициенті (k)реакцияның жылдамдығының константасы деп аталады.Бұл константаның мәні әрбір реакция үшін тұрақты шама,ол тек реакцияласушы заттардың табиғатына және темперетураға тәуелді.
Реакция жылдамдығының әрекеттесуші заттардың концентрациясына тәуелділігі  =k
=k  .теңдеу түрінде өрнектелген ондағы ni шамасы (i=1,2,3….) реакцияның Ai заты бойынша алынған реттілігі деп атайды.Химиялық кинетикада реакцияның реттілігі деп кинетиканың негізгі заңының теңдеуіндегі зат концентрацияларының дәреже көрсеткіштерінің қосындысын айтамыз.
.теңдеу түрінде өрнектелген ондағы ni шамасы (i=1,2,3….) реакцияның Ai заты бойынша алынған реттілігі деп атайды.Химиялық кинетикада реакцияның реттілігі деп кинетиканың негізгі заңының теңдеуіндегі зат концентрацияларының дәреже көрсеткіштерінің қосындысын айтамыз.
Мысалға n=0  =-dc/dt=k реттілігі нолге тең
=-dc/dt=k реттілігі нолге тең
n=1  =-dc/dt=kc реттілігі бірге тең
=-dc/dt=kc реттілігі бірге тең
n=2  =-dc/dt=kc2 реттілігі екіге тең.
=-dc/dt=kc2 реттілігі екіге тең.
Химиялық кинетикада реакцияның реттілігімен қатар реакцияның молекулалығы деген ұғым да пайдаланылады. Реакцияның молекулалығы деп әрекеттесуші заттардың реакцияның элементар актісіне қатынасын молекулаларының санын айтады.Химиялық реакцияның элементар актісіде реакцияның молекулалығы мен реттілігі бір біріне сәйкес келеді.Мысалы,элементар реакцияға азометанның азоэтан мен азотқа айырылу реакциясы жатады:
CH3N2CH3  C2H6+N2
C2H6+N2
