Кейбір тотығу – тотықсыздану жүйелерінің стандартты потенциалдары
| Тотығу – тотықсыздану жұбы | Жартылай реакция | Ео, В. |
| Na+/Na Mg 2+ / Mg Al3+ / Al | Na – ē = Na+ Mg2+ +2 ē =Mg Al3+ +3e = Al | -2,71 -2,37 -1,66 |
| Тотығу – тотықсыздану жұбы | Жартылай реакция | Ео, В. |
| Cr2+/ Cr Zn2+ / Zn Fe 2+/Fe Cr3+/Cr2+; Pt Cd2+/ Cd Ni2+/Ni Pb2+/Pb 2H+/H2; Pt Sn4+/Sn2+; Pt Cu2+/Cu+; Pt S4O62-/2S2O32-; Pt Cu2+/Cu Fe(CN)63-/Fe(CN)64-; Pt Cu+/Cu J2/2J-; Pt AsO43-/AsO33-; Pt Fe3+/Fe2+; Pt Hg2+/2Hg Ag+/Ag NO3-/NO2-, Pt 2Hg2+/Hg22+; Pt Br2/2Br-; Pt Cr2O72-/2Cr3+; Pt Cl2/2Cl-; Pt BrO3-/Br-; Pt MnO4-/Mn2+; Pt Ce4+/Ce3+; Pt MnO4-/MnO2; Pt H2O2/H2O; Pt | Cr2+ + 2 ē =Cr Zn2+ +2 ē = Zn Fe2+ + 2 ē = Fe Cr3+ + ē =Cr2+ Cd2+ + 2 ē = Cd Ni2++2 ē = Ni Pb2++2 ē = Pb 2H++2 ē = H2 Sn4++2 ē =Sn2+ Cu2++ ē = Cu+ S4O62-+2 ē =2S2O32- Cu2++2 ē =Cu Fe(CN)63-+ ē =Fe(CN)64- Cu++ ē =Cu J2+2 ē = 2J- AsO43-+2H++2 ē =AsO33-+H2O Fe3++ ē =Fe2+ Hg2++2 ē =2Hg Ag++ ē =Ag NO3-+2H++NO2-+H2O 2Hg2++2 ē =Hg22+ Br2+2 ē =2Br- Cr2O72+14H++6 ē =2Cr3++7H2O Cl2+2 ē =2Cl- BrO3-6H++6 ē =Br-+3H2O MnO4-+8H++5 ē =Mn2++4H2O Ce4++ ē =Ce3+ MnO4-+4H++3 ē =MnO2+2H2O H2O2+2H++2 ē =2H2O | -0,86 -0,76 -0,44 -0,41 -0,40 -0,25 -0,12 -0,00 +0,15 +0,15 +0,15 +0,34 +0,36 +0,52 +0,53 +0,58 +0,77 +0,789 +0,799 +0,835 +0,92 +1,06 +1,33 +1,36 +1,42 +1,51 +1,61 +1,69 +1,77 |
Тотығу – тотықсыздану реакцияларының бағытын анықтау
Тотығу – тотықсыздану реакцияларының бағытын стандартты тотығу – тотықсыздану потенциалдарын салыстырып анықтайды. Реакцияның қаншалықты толық жүргенін білу үшін тотығу – тотықсыздану реакциясының тепе – теңдік константасын табу қажет. Мысалы, 2Fe3+ + Sn2+ ↔2 Fe 2+ + Sn4+ реакциясының тепе теңдік константасы:
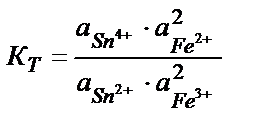
Жүйеде тепе – теңдік орнағанда реакцияға қатысатын тотығу – тотықсыздану жұптарының потенциалдары теңеседі:
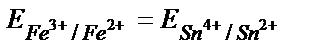
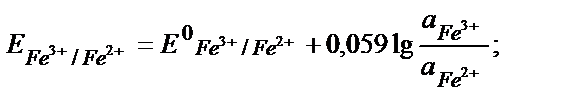
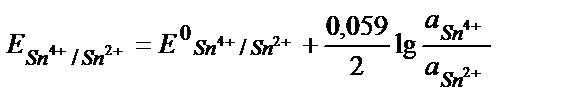
Еске алатын бір жағдай, жартылай реакцияның теңдігінде жалпы реакцияға қатысатын заттардың моль мөлшерін жазу керек:
Fe3+ + е ↔ Fe 2+ /2 2 Fe3+ +2е ↔ 2 Fe 2+ , онда:
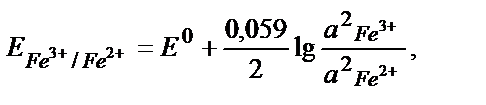 осыдан:
осыдан:
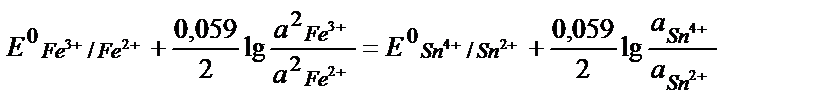
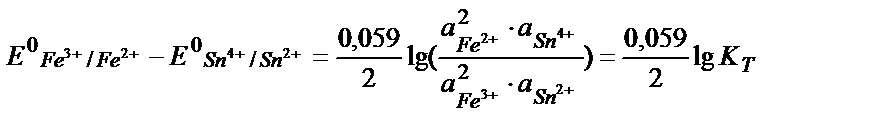
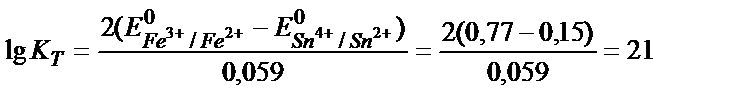 ;
; 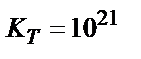
Жалпы түрінде
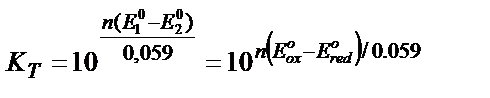
Тағы бір мысал:
MnO4- +5Fe2+ +8H+ ↔ Mn 2+ + 5Fe3+ + 4H2O реакцияның тепе – теңдік константасының мәнін табу:
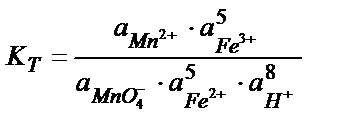
Жартылай реакциялар мен оларға сәйкес стандартты потенциалдар:
MnO4- +8H++5e ↔ Mn2+ + 4H2O 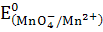 = +1, 51 В
= +1, 51 В
5Fe2+ +5е ↔ 5Fe3+ 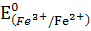 = +0,77 В
= +0,77 В
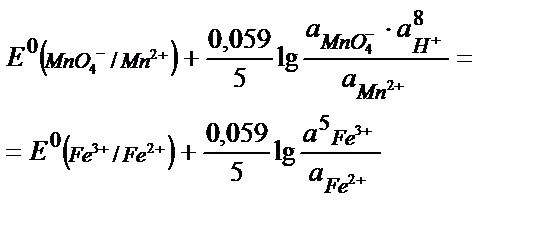
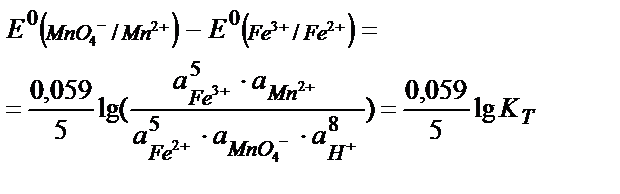
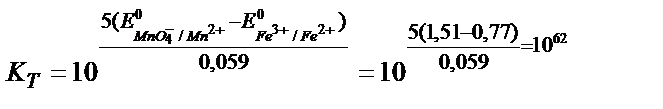
Аяғына дейін жүретін реакцияның тепе теңдік константасы 108 тең, не одан көп болу керек, яғни:
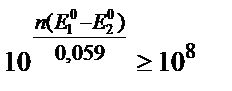
Бұл шарт n=1 үшін (E10 – E 20) ≈ 0,4B, n=2 үшін (E10 – E 20) ≈ 0,2B болғанда сақталады.
Сонымен, тотығу – тотықсыздану реакцияларының бағыты және олардың аяғына дейін жүру-жүрмеуі реакцияға қатысатын жүйелердің тотығу-тотықсыздану потенциалдарының айырымымен анықталады. Потенциалдардың айырымы неғұрлым көп болса, соғұрлым реакция аяғына дейін толық жүреді.
Тотығу – тотықсыздану потенциалына әртүрлі факторлардың әсері
Ерітіндінің иондық күшінің әсері
Ерітіндінің иондық күшінің өзгеруі иондардың активтік коэффициенттерін өзгертеді. Әдетте заттың тотыққан түрінің заряды тотықсызданған түрінің зарядынан басқаша болатындықтан олардың активтік коэффициенттері әртүрлі дәрежеде өзгереді. Ерітіндінің иондық күшінің әсерін реалды стандартты потенциалды пайдаланып ескеру ыңғайлы. Мысалы,
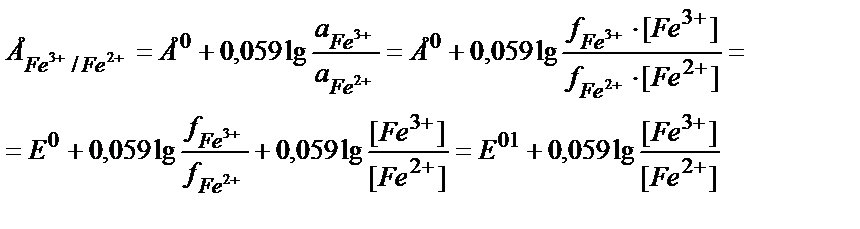
Е01 – реалды жағдайдағы активтік коэффициентерді еске алатын стандартты потенциал:
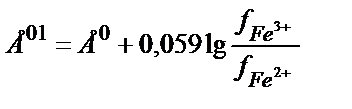 ; Жалпы түрде:
; Жалпы түрде: 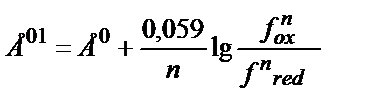
Ерітіндінің иондық күші (J) тұрақты болғанда Е01 мәні де тұрақты болады.
