Способы выражения концентрация растворов
Наиболее часто применяемые способы выражения концентрации:
массовая доля,
молярная концентрация,
молярная концентрация эквивалента,
молярная доля,
объемная доля,
титр.
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах.
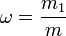 ,
,
где:
§ m1 — масса растворённого вещества, г ;
§ m — общая масса раствора, г .
Объёмная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах.
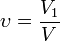 ,
,
где:
§ V1 — объём растворённого вещества, л;
§ V — общий объём раствора, л.
Мольная (молярная) доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
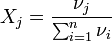 ,
,
где:
§ νi — количество i-го компонента, моль;
§ n — число компонентов;
молярная концентрация эквивалента,Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
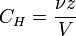 ,
,
где:
§ ν — количество растворённого вещества, моль;
§ V — общий объём раствора, л;
§ z — число эквивалентности.
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4.
Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации CM , которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным. Примечание: единица «моль» не склоняется по падежам. После цифры пишут «моль», подобно тому, как после цифры пишут «см», «кг» и т. д.
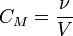 ,
,
где:
§ ν — количество растворённого вещества, моль;
§ V — общий объём раствора, л.
Титр раствора — масса растворённого вещества в 1 мл раствора.
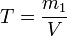 ,
,
где:
§ m1 — масса растворённого вещества, г;
§ V — общий объём раствора, мл;
4. Коллигативные свойства растворов неэлектролитов. Понижение давления пара
Коллигативными (коллективными) называются свойства растворов относительно свойств растворителя, зависящие от числа растворенных частиц.
Растворы СВОИМИ свойствами отличаются от чистых растворителей. Например, давление пара растворителя над раствором ниже, чем над чистым растворителем.
Это понижение прямо пропорционально мольной доле растворенного нелетучего неэлектролита (закон Рауля). Математически закон Рауля можно представить так:
 p= Kx,
p= Kx,
 где р — понижение давления пара; х — мольная доля растворенного вещества; К — константа, равная р при х=1. Растворенное вещество, занимая часть объема раствора, покидает концентрацию частиц растворителя и соответственно этому уменьшает число их, переходящих в пар.
где р — понижение давления пара; х — мольная доля растворенного вещества; К — константа, равная р при х=1. Растворенное вещество, занимая часть объема раствора, покидает концентрацию частиц растворителя и соответственно этому уменьшает число их, переходящих в пар.
Из этого закона можно сделать вывод, что температура замерзания растворов ниже, а температура кипения их (если растворенное вещество нелетуче) выше, чем у чистых растворителей, причем повышение температуры кипения и понижение температуры замерзания растворов неэлектролитов прямо пропорциональны их моляльной концентрации. В результате1 водные растворы кипят при температуре выше 100° С и замерзают при температуре ниже 0° С.
