Взаимодействие иодата натрия с сульфитом натрия
Федеральное агентство по образованию Государственное
Образовательное учреждение высшего профессионального
Образования (ГОУ ВПО)
Уфимский государственный нефтяной технический
Университет Филиал УГНТУ в г. Салавате
Общая химия
Отчет по лабораторной работе №4
«СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ»
ХТП-220700.65-04. ЛР
Исполнитель:
Студент гр. БАТ-12-21 Е.В.Новоженин
Руководитель:
Доцент Р. Р.Вахидов
Салават 2012
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
0пыт 1. Влияние среды на смещение химического равновесия
Соли хромовой кислоты - хроматы - окрашены в желтый цвет, а соли дихромовой кислоты – дихроматы – в оранжевый цвет. В растворах этих солей имеет место равновесие:
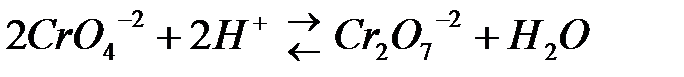 ,
,
которое легко смещается при изменении концентрации ионов водорода.
Выполнение работы: в пробирку внести 5-6 капель раствора дихромата калия и прибавить столько же капель разбавленного раствора гидроксида натрия. Наблюдать переход окраски. Затем к этому же раствору по каплям прибавить раствор серной кислоты до тех пор, пока окраска раствора станет прежней.
Запись данных опыта
0пыт 2. Влияние концентрации реагирующих веществ на смещение химического равновесия
Взаимодействие хлорида железа с роданидом калия или аммония
Выполнение работы: В четыре пробирки по 5-7 капель внести 0,2 н раствора хлорида железа (III) и роданида калия или аммония. Растворы размешать стеклянной палочкой и поставить в штатив. Одну пробирку с полученным раствором сохранить для сравнения результатов опыта. В остальные пробирки добавить следующие реактивы: в первую пробирку – 1 каплю насыщенного раствора хлорида железа (III), во вторую – 1 каплю насыщенного раствора роданида калия или аммония, в третью – несколько кристалликов хлорида калия. Сравнить интенсивность окраски полученных растворов с интенсивностью окраски эталона.
Запись данных опыта:
Опыт 3. Влияние концентрации реагирующих веществ на скорость химической реакции
Взаимодействие иодата натрия с сульфитом натрия
Процесс окисления сульфита натрия иодатом натрия выражается общим уравнением :
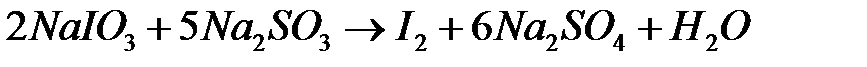
Указанная реакция протекает ступенчато по уравнениям:
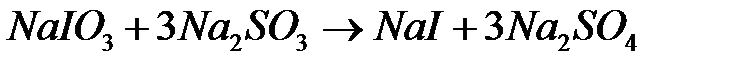
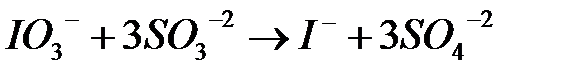
После полного окисления 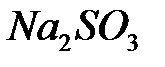 образовавшийся иодит натрия вступает во взаимодействие с непрореагировшим иодатом натрия :
образовавшийся иодит натрия вступает во взаимодействие с непрореагировшим иодатом натрия :
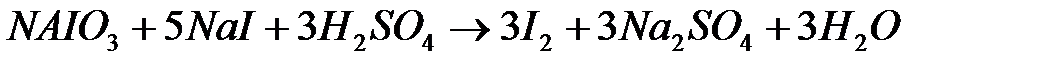
Выделяющийся молекулярный йод образует с присутствующим в растворе крахмалом соединение, окрашенное в синий цвет. Появление указывает на начало второй реакции и конец первой. Может ли появиться свободный йод в присутствии 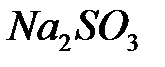 ? Так как реакция окисления сульфита иодатом протекает довольно медленно, время ее протекания можно измерить с помощью секундомера, считая началом реакции момент приливания сульфита натрия к раствору иодата, а концом - появление синей окраски.
? Так как реакция окисления сульфита иодатом протекает довольно медленно, время ее протекания можно измерить с помощью секундомера, считая началом реакции момент приливания сульфита натрия к раствору иодата, а концом - появление синей окраски.
Выполнение работы:в двух сухих пробирках приготовить одинаковые объемы растворов иодата натрия различной концентрации. Для этого в первую пробирку внести 4 капли 0,02 н раствора иодата натрия и 12 капель дистиллированной воды. Во вторую пробирку 8 капель этого же раствора и 8 капель воды. Таким образом концентрация иодата натрия во втором случае будет в 2 раза больше, чем в первом.
Приготовить восстановительную смесь, для чего 2 микрошпателя сульфата натрия внести в пробирку и растворить в 10 каплях воды. В раствор добавить 10 капель свежеприготовленного крахмала и 2 капли 1 н раствора серной кислоты. Смесь размешать стеклянной палочкой, включить секундомер, внести 2 капли восстановительной смеси в первую пробирку. По секундомеру измерить время от момента добавления восстановительной смеси до появления в растворе синей окраски.
Так же внести 2 капли восстановительной смеси в пробирку № 2, измеряя время по секундомеру. Сопоставить различие в концентрации иодата натрия с различием времени течения реакции (появление синей окраски в пробирках № 1 и № 2).
Запись данных опыта:
Таблица 1
| № пробирки | Число капель NaIO3 | Число капель Н2О | Число капель восста но-вителя | Общий Объем Раст- Вора | Концен-трация Na2SO3 | Время тече ния реак- ции | Скорость реакции в у.е. | 1/τ, сек |
| С | ||||||||
| 2С | ||||||||
| 3С |
Опыт5. Влияние катализаторов на скорость реакции.
Каталитическое восстановление железа (III).
Выполнение работы: в две пробирки внести 10 капель 0,5 н раствора роданида калия или аммония и по 1 капле 0,5н раствора хлорида железа (III). Что наблюдается ? В одну пробирку добавить 1 каплю 1 н раствора сульфата меди. В обе пробирки внести по 10 капель тиосульфата натрия. Наблюдать различную скорость обесцвечивания растворов, которое происходит вследствие восстановления железа (III) до железа (II) тиосульфатом натрия ( 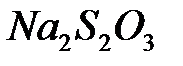 ).
).
Запись данных опыта:
FeCl3 + 3KCNS = Fe(CNS)3 +3KCl
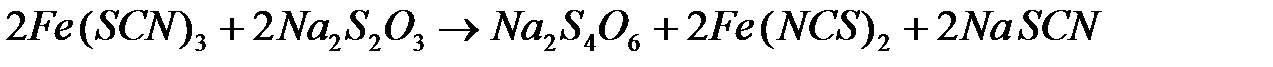
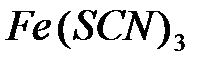 - красный раствор.
- красный раствор.
