Правила и принципы заполнения АО электронами
Строение многоэлектронных атомов. Квантовые числа
Квантово-механическая модель атома использует вероятностный подход для характеристики нахождения электрона в определенной области пространства.
Атомная орбиталь (АО) – область пространства, в котором наиболее вероятно нахождение электрона. АО однозначно характеризуется тремя квантовыми числами (КЧ) n, l, ml,а состояние электрона в атоме – четырьмя квантовыми числами: n, l, ml и ms.
Главное квантовое число n - характеризует удаленность электрона от ядра и определяет энергию и размеры атомных орбиталей (АО), принимает значения n = 1,2,3…∞, что соответствует энергетическому уровню. Чем выше значение n, тем выше энергия.
Орбитальное квантовое число l - характеризует форму атомной орбитали, принимает целочисленные значении от 0 до (n-1) и характеризует энергетический подуровень. Разная форма АО определяет разную энергию в пределах одного энергетического уровня (энергетический уровень расщеплен на подуровни). Максимальное число энергетических подуровней на n – уровне равно n (количество подуровней равно номеру уровня).
Магнитное квантовое число ml - характеризует пространственную ориентацию атомной орбитали во внешнем магнитном или электрическом поле, принимает целочисленные значения ml =-l, …, 0, …, +l, на подуровне (2l +1) значений ml и (2l +1) орбиталей.ml - вектор (имеет величину и направление). Все АО одного подуровня в отсутствие внешнего поля имеют одинаковое значение энергии.
Общее число орбиталей на n-ом энергетическом уровне равно n2.
Спиновое квантовое число ms – характеризует величину и ориентацию «спина», ms принимает только два значения: +½ (↑) и -½ (↓). Спин - собственный механический момент количества движения электрона, связанный с его вращением вокруг своей оси (спин – вектор).
| ↑↓ |
Максимально возможное число электронов на n-ом энергетическом уровне равно 2n2.
На первом уровне (n=1) → один подуровень (1s) 1АО 2ē
На втором уровне (n=2) → два подуровня (2s, 2p) 4АО 8 ē
На третьем уровне (n=3) → три подуровня (3s, 3p, 3d) 9АО 18 ē
На четвертом уровне (n=4) → четыре подуровня (4s, 4p, 4d, 4f) 16АО 32 ē
Еs<Еp<Еd<Еf для одного уровня
АО: это совокупность положений электрона в атоме с определенными n, l, ml (т.е. энергией, размерами, формой и ориентацией в пространстве), условно АО обозначают □
Одна s орбиталь □ l= 0 ml= 0
(сфера)
Три p орбитали □□□ l= 1 ml= -1,0,+1
(гантели)
Пять d орбиталей □□□□□ l= 2 ml= -2,-1,0,+1,+2
(4-хлепестковые розы)
Семь f орбиталей □□□□□□□ l= 3 ml= -3,-2,-1,0,+1,+2,+3
(сложная форма)
 | 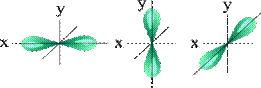 |
| S - орбиталь | Три p – орбитали |
 |
| Пять d – орбиталей |
Правила и принципы заполнения АО электронами
1. Принцип минимальной энергии – в основном состоянии первыми заполняются орбитали с наименьшей энергией, соответствующие наиболее устойчивому состоянию. АО с min E – это 1s.
2. Правило В. Клечковского - увеличение энергии орбиталей происходит в порядке возрастания суммы (n+l), а при равной сумме (n+l) в порядке возрастания n
1s<2s<2p<3s<3p<4s≈3d<4p<5s≈4d<5p<6s≈5d≈4f<6p<7s≈6d≈5f<7p
Для 4s АО сумма (n+l) =4+0=4. Для 3d АО сумма (n+l) =3+2=5
3. Принцип запрета Паули - в атоме не может быть двух электронов, обладающих одинаковым набором четырех квантовых чисел n, l, ml, ms . Следовательно, на каждой орбитали может быть не более двух электронов, причем они должны иметь противоположные спины (↑↑ или ↓↓ - невозможно).
| ↑↓ |
4. Правило Гунда – электроны, имеющие одинаковое значение l, но разное ml занимают АО так, чтобы сумма спиновых чисел была максимальной (знак не имеет значения).
р4
| ↑↓ | ↑ | ↑ |
Max ∑ ms = ½ - ½ + ½ + ½ = 1
Электронная конфигурация атома - запись распределения электронов в атоме по уровням и подуровням. Формирующий электрон – ē, который последним заполняет орбитали атома.
15Р 1s2 2s2 2p6 3s2 3p3 - полная электронная формула.
Р … 3s2 3p3 3s 3p
| ↓↑ | ↓ | ↓ | ↓ |
краткая электронная конфигурация. Формирующий электрон 3p3: n=3, l=1 ml= -1,0,+1 (одно из трех значений), ms = +½ или -½ .
Валентные электроны составляют краткую электронную конфигурацию атома
В ПСЭ различают 4 группы элементов, называемых по формирующему электрону s-, p-, d-, f- элементы.
Краткая электронная конфигурация:
для s-элементов (подгруппы IА, IIА, Н и Не) ns1-2, n- номер периода
19К …4s1
для p- элементов (IIIА–VIIIА) ns2np1-6,
4B …2s22p1
для d-элементов (IБ–VIIIБ) (n-1)d1-10ns2(1,0) (n-1)–предвнешний энергетический уровень,
21Sc …3d14s2
(– у Pd; ns1,0 –«провал» ns-электронов на (n-1)d подуровень, это связано с более низкой энергией конфигурации (n-1)d10 и (n-1)d5по сравнению с d9 и d4)
для f-элементов (лантанидов и актинидов) (n-2)f1-14(n-1)d1(0)ns2 (n-2)–предпредвнешний энергетический уровень (d0 –«провал» d-электрона)
64Gd …4 f7 5d1 6 s2
Валентность - способность атома образовывать определенное число химических связей. Валентность по обменному механизму равна числу внешних неспаренных электронов в атоме. Различают валентность в основном (В) и возбужденном (В*) состоянии атома.
Кислород, азот и фтор – возбужденного состояния нет (нет 2d-подуровня)
Распаривание электронов возможно только в пределах одного энергетического уровня.
У магния Mg…3s2 в основном состоянии нет неспаренных электронов (В=0), при переходе в возбужденное состояние и распаривании 3s-ē В*=2.
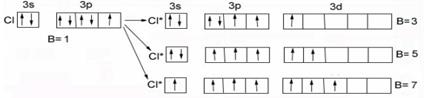
Хлор Cl…3s23p5 (аналог фтора) – валентности: В=1, В*= 3, 5, 7 - вследствие наличия свободных d-орбиталей на третьем энергетическом уровне
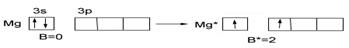 |
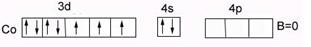
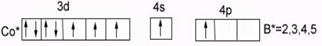
У кобальта Cо…3d74s2 В0=0 – нет внешних неспаренных электронов в основном состоянии. В возбужденном состоянии В*=2,3,4,5, распаривания 3d парных ē невозможно (на n=3 нет f-подуровня).
Физический смысл периодического закона:
