Окислительно-восстановительные процессы с органическими соединениями. Усложненные реакции с неорганическими соединениями. (ЗОЛОТОВ)
Окислительно-восстановительные реакции с органическими
соединениями.
1) С2Н5ОН + КMnO4 ® Mn2+ + CO2
 С2Н5ОН + 3Н2О – 12е ® 2CO2 + 12Н+ 5
С2Н5ОН + 3Н2О – 12е ® 2CO2 + 12Н+ 5
MnO4– + 8Н+ + 5е ® Mn2+ + 4Н2О 12
5С2Н5ОН + 15Н2О + 12MnO4– + 96Н+ ® 10CO2 + 60Н+ + 12Mn2+ + 48Н2О
5С2Н5ОН + 12MnO4– + 36Н+ ® 10CO2 + 12Mn2+ + 33Н2О
5С2Н5ОН + 12КMnO4 + 18Н2SO4 ® 10CO2 + 12MnSO4 + 6К2SO4 + 33Н2О
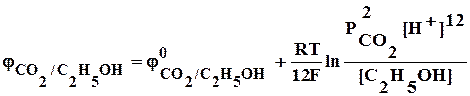
As2S3 + HNO3 + … ® AsO43- + SO42- + N2 +…

 As2S3 + 20 Н2О – 28е ® 2 AsO43- + 3 SO42- + 40Н+ 10 5
As2S3 + 20 Н2О – 28е ® 2 AsO43- + 3 SO42- + 40Н+ 10 5
 2 NO3– + 12 H+ + 10е ® N2 + 6 Н2О 28 14
2 NO3– + 12 H+ + 10е ® N2 + 6 Н2О 28 14
5As2S3 + 100 Н2О + 28 NO3– + 168 H+ ® 10 AsO43- + 15SO42- +200 Н+ + 14N2 + 84Н2О
5As2S3 + 16 Н2О + 28 NO3– ® 10 AsO43- + 15 SO42- + 32 Н+ + 14N2
5As2S3 + 16 Н2О + 28 НNO3 ® 10 Н3AsO4 + 15 Н2SO4 + 14N2
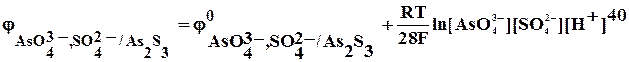
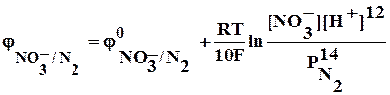
As2S3 + HNO3 + … ® AsO43- + SO42- + NО +…
 As2S3 + 20 Н2О – 28е ® 2 AsO43- + 3 SO42- + 40Н+ 3
As2S3 + 20 Н2О – 28е ® 2 AsO43- + 3 SO42- + 40Н+ 3
 NO3– + 4 H+ + 3е ® NО + 2 Н2О 28
NO3– + 4 H+ + 3е ® NО + 2 Н2О 28
3As2S3 + 60 Н2О + 28NO3– + 112 H+® 6 AsO43- + 9 SO42- + 120 Н+ +28 NО + 56 Н2О
3As2S3 + 4 Н2О + 28NO3– ® 6 AsO43- + 9 SO42- + 8 Н+ +28 NО
3As2S3 + 4 Н2О + 28 НNO3 ® 6 Н3AsO4 + 9 Н2SO4 + 28 NО
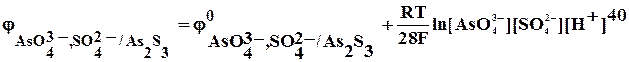
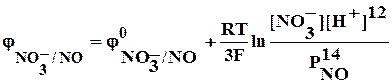
С6Н12О6 + КMnO4 ® Mn2+ + CO2 + …
 С6Н12О6 + 6Н2О – 24е ® 6CO2 + 24Н+ 5
С6Н12О6 + 6Н2О – 24е ® 6CO2 + 24Н+ 5
MnO4– + 8Н+ + 5е ® Mn2+ + 4Н2О 24
5 С6Н12О6 + 30Н2О + 24MnO4– + 192Н+ ® 30CO2 + 120Н+ + 24Mn2+ + 96Н2О
5 С6Н12О6 + 24MnO4– + 72Н+ ® 30CO2 + 24Mn2+ + 66Н2О
5 С6Н12О6 + 24КMnO4 + 36Н2SO4 ® 30CO2 + 24MnSO4 + 12К2SO4 + 66Н2О

Комплексообразование в аналитической химии. Задачи по теме.
Классификация комплексных соединений по характеру взаимодействия мегалл-лиганд. Внутри- и внешнесферные комплексы, гомо- и гетеролигандные, моно- и полидентатные. Многоядерные комплексы. Хелаты, внутрикомплексные соединения. (Золотов. Самостоятельно)
КОМПЛЕКСООБРАЗОВАНИЕ В АНАЛИТИЧЕСКОЙ ХИМИИ
Комплексные соединения очень широко используются как в качественном, так и в количественном анализе. В количественном анализе имеется мощный метод – комплексонометрическое титрование. В качествнном широко используется тот факт, что комплексные соединения часто очень ярко окрашены. В целом ряде случае они не растворимы. Можно получить не только яркую различную окраску, используя реакцию с образованием или превращением комплексных соединений, но и получить красивые окрашенные осадки, что немаловажно.
Примеры.
Ni3[Co3+ (CN)6]2 зеленая гексацианокобальтат III никеля II
Co2[Ce+4 (CN)6]3 розово-красная гексацианоцеррат IV дикобальта III
K3[Co(NO2)6] желтый осадок гексанитритокобальтат III калия
Fe2+3[Fe3+(CN)6]2 синий осадок гексацианоферрат III железа II
Fe3+4[Fe2+(CN)6]3 синий осадок гексацианоферрат II железа III
[Cu(NH3)4](OH)2 синий раствор дигидроксилтетраммиаката меди II
Cu[Fe(CN)4]2 красная окраска тетрацианоферрат III меди
Если комплексообразователем является анион, то центральному атому дается латинское название + суффикс «ат».
Если комплексообразователем является катион, то центральному атому дается русское название в родительном падеже (кого, чего?)
Если несколько центральных атомов в составе комплексной частицы, то такой комплекс называют полиядерным.
Если в составе внутренней сферы комп. соединения имеется лиганд, занимающий 2 и более координационных места, то его называют полидентантным.
В кислотно-основном титровании широко используется окраска аммиакатов
[Cu(NH3)4]2+ или [Cd(NH3)4]2+.
Очень важную роль в аналитической химии играет комплексообразование в случае, когда в растворе имеются мешающие элементы, изменяющие окраску раствора при анализе искомых элементов, основанном на определенной базовой реакции. Тогда применяют способ маскировки мешающих элементов. Например, соединения железа интенсивно окрашены, могут выпадать в осадок. Если Fe3+ не является искомым объектом, а лишь мешает, то его можно замаскировать, спрятать от базовой реакции. Это можно сделать, если ввести в систему лиганды, образующие с Fe3+ очень прочные, бесцветные комплексы. Тогда катионы железа не будут окрашивать раствор, не выпадут в осадок. Это достижимо, если константа устойчивости Кст очень велика
Например: [Fe(PO4)2]3- [FeF6]3- [Fe(C2O4 ) 3]3- [Fe(C4H4O6)3]3-
Татртраты, соли винной кислоты широко используются в аналитической химии.
О=С – СН - СН - С=О
│ ½ ½ ½
ОН ОН ОН ОН
Для анализа большого числа катионов широко используется этилендиаминтетрауксусная кислота и ее натриевая соль (трилон Б). Анион ЭДТА образует прочные комплексные ионы с катионом. Некоторые из них неокрашены.
(СН2СООН)2N-CH2-CH2-N(HOOCH2C)2
или СН2СООН - N-CH2-CH2-N - NaOOCH2C
½ ½
СН2СООNa HOOCH2C
Сильнейшим маскировочным средством является трифосфат натния (в лаборатории 6-водный). Na5P3O10 дает очень прочные комплексы с большим количеством катионов.
2,5 Na2O∙3/2P3O5∙6H2O c Li+; Be2+; Mg2+; Ca2+; Pb2+; Al3+; Hg2+; Sn4+; Sn2+; Fe2+; Fe3+; Co2+; Ni2+; Mn2+; Sr2+; Ba2+
Эти катионы не только маскируются, но и не образуют осадков при введении аммиака и фосфатов. Они не маскируют осаждение Ag+; Bi3+; Cd2+; Cu2+; Hg+
Ступенчатое комплексообразование. Константы устойчивости (ступенчатые и общие).
Факторы, влияющие на комплексообразование: строение центрального атома и лиганда. Концентрация компонентов раствора, рН, ионной силы раствора.
Важнейшие реагенты, применяемые в анализе для разделения, обнаружения, определения ионов металлов, маскировки.
(Na – O)2P =O комплексное соединение, имеющее более 1
è лиганда диссоциирует по нескольким ступеням
O
/ При этом число ступеней равно числу лигандов
Na – O – P =O внутренней сферы.
è
O
/
(Na – O)2P =O
Например, [Hg(CN)4]2- « [Hg(CN)3] - + CN- 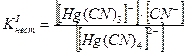
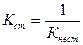
[Hg(CN)3] - « Hg(CN)2 + CN- 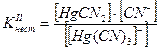
Hg(CN)2 « HgCN+ + CN- 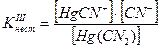
HgCN+ « Hg2+ + CN- 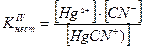
Если перемножить выражения соответствующих констант нестойкости, то получим общую константу нестойкости, соответствующую полной диссоциации комплексного образования.
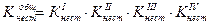
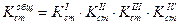
Как же изменяются константы нестойкости и стойкости по величине?
В каждой предшествующей ступени образуется одноименный ион. В соответствии с принципом Ле-Шателье за счет наличия одноименного иона в предшествующей ступени константа диссоциации последующей ступени смещается в сторону недиссоциированной формы, а следовательно Кнест уменьшается. 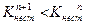
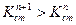
Понимание и знание характера комплексного соединения позволяет рассчитывать концентрации простых ионов в растворах, если известны исходные концентрации, константы стойкости и константы нестойкости для данного комплекса.
Пример.
Найти концентрацию CN- и Hg+ в децимолярном растворе тетрациан+2меркурат-ион, если 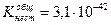
[Hg(CN)4]2- « Hg2+ + 4CN-
0,1 – х х 4х 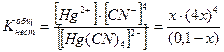
расчетное уравнение имеет степень на единицу больше. Чем число лигандов. Такое уравнение дает 5 ответов. Методом Штурма – 5 корней, из них только 1 действительный, остальные – отрицательные или комплексные. Этот действительный корень и является ответом. х £ 0,1
256 х5 = 0,1 Кнест 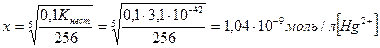
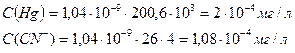
При диссоциации комплексных ионов в растворе, как правило, оказываются все виды продуктов диссоциации, т.е. комплексные ионы с числом лигандов во внутренней сфере и меньше начального. Чтобы рассчитать нужно знать метод расчета и распределительную диаграмму.
В учебнике Золотова приведены различные методы расчета.
Подобные методы позволяют решить и более сложные задачи. Например: Оценить разрушаемость комплексного иона [Ag(CN)2]-, если к фиксируемому объему 10-3 миллимолярного раствора соли добавить в различные пробы одинаковые объемы KCl; KI той же концентрации. Кнест= 10-21, а ПР (AgI) = 1,5∙10-16; Lp (AgCl) = 1,8∙10-10. C0 = 1023.
[Ag(CN)2]- « Ag+ + 2CN-
10-3-x x 2x 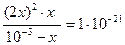
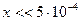
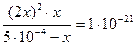
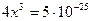
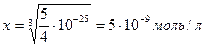
осадок образуется, когда произведение концентраций ионов больше Lp
C1V1 = C2V2
C = 5∙10-9 ∙ 5∙10-4=2,5∙10-12 концентрации Ag+ и Cl-
Осадка не образуется, т.к. 2,5∙10-12 < ; Lp (AgCl) = 1,8∙10-10. Дальнейшего разрушения комплексного иона не происходит.
ПР (AgI) = 1,5∙10-16 < C = 5∙10-9 ∙ 5∙10-4=2,5∙10-12 осадок образуется.
Рассчитать долю продиссоциировавших комплексных ионов до введения в раствор хлоридов и иодидов.
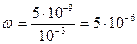 или 5∙10-4 %.
или 5∙10-4 %.
