Кинетика гетерофазных реакций в системе жидкость-жидкость
В жидкофазных реакциях, где реагенты окружены молекулами растворителя, необходимым условием начала химической реакции является сближение реагирующих частиц на некоторое критическое расстояние, соответствующее переходному состоянию реакции. При этом возникает вопрос о влиянии диффузии реагентов в жидкости, обладающей определенной вязкостью. Подробнее роль диффузии в кинетике жидкофазных реакций рассматривается в разделе, посвященном эффектам сольватации, здесь же следует иметь в виду, что процессы диффузии могут лимитировать (т.е. ограничивать, или определять) скорость ряда органических реакций.
Такие реакции называются диффузионно-контролируемыми. К ним относятся гомогенные реакции, проводимые в очень вязких средах, где энергия активации процесса диффузии выше, чем энергия активации химической реакции, а также гомолитические, радикальные реакции, протекающие почти безбарьерно, т.е. с очень низкой энергией активации, и гетерофазные гомогенные реакции с низким коэффициентом распределения реагентов в реакционной фазе. Диффузионный контроль реакции можно распознать по влиянию на скорость вязкости среды, по температурному коэффициенту скорости (для кинетически контролируемых процессов при повышении температуры на 10оС скорость реакции возрастает в 2-4 раза, а для диффузионных процессов - менее, чем в 2 раза) и по порядку реакции (диффузионные процессы всегда имеют первый порядок). В случае гетерофазных процессов области диффузионного и кинетического контроля можно установить по влиянию на скорость интенсивности перемешивания (вначале, в зоне диффузионного контроля скорость реакции возрастает при увеличении интенсивности перемешивания, а затем при переходе в зону кинетического контроля перестает от нее зависеть). Для таких процессов, где химическая реакция протекает в одной из фаз, например, ароматического нитрования в серно-азотной кислотной смеси

когда ароматический углеводород ArH вначале диффундирует в кислотную фазу, где подвергается нитрованию, а затем возвращается в органическую фазу, применима теория обновления поверхности Данквертса-Астариты. Согласно этой теории скорость массопереноса (WD) определяется уравнением
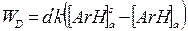
где a' - удельная поверхность раздела фаз (на единицу объема),
k - коэффициент массопереноса,
[ArH]a - концентрация ArH в кислотной фазе,
[ArH]aS -концентрация насыщенного раствораArH в кислотной фазе
Скорость нитрования ArH в кислотной фазе дается уравнением
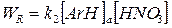 ,
,
где k2–бимолекулярная константа скорости нитрования.
Для последовательных реакций с обратимыми стадиями, к числу которых относится гетерофазное ароматическое нитрование, применим принцип стационарного состояния реакционноспособного промежуточного вещества (принцип Боденштейна). Суть его в том, что с повышением скорости диффузии увеличивается концентрация [ArH]aи, соответственно, его потребление в реакции нитрования. При этом рано или поздно наступает момент, когда скорости обоих процессов выравниваются и концентрация [ArH]aперестает изменяться, т.е. становится стационарной:
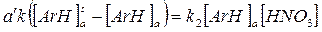
Отсюда легко определить эту стационарную концентрацию:
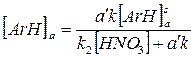
и выражение для скорости химической реакции будет иметь вид:
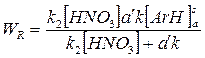
Возможны два граничных условия:
1. Если k2[HNO3]>>a’k, т.е. скорость реакции значительно выше скорости диффузии, то WR=a’k[ArH]sa, т.е. наблюдается кинетика псевдонулевого порядка и реакция контролируется массопереносом (диффузионный контроль процесса);
2. Если a’k>> k2[HNO3], т.е. скорость реакции значительно меньше скорости диффузии, то WR= k2[HNO3][ArH]sa и реакция имеет псевдопервый порядок (кинетический контроль процесса).
Для процессов, протекающих в обычных маловязких средах, существует т.н. диффузионный предел скорости химической реакции, при котором константа скорости бимолекулярных процессов не может превышать 1010-1011 л.моль-1с-1.
