Зависимость скорости реакции от концентраций реагентов
Влияние концентраций реагирующих веществ на скорость реакции выражается основным законом химической кинетики (законом действующих масс‑ К. Гульдберг и П. Вааге 1867 г.):
Скорость химической реакции, протекающей при постоянной температуре в гомогенной среде, пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов.
Так, для гомогенной обратимой реакции, протекающей по уравнению:
aA + bB ⇄ cC + dD,
скорости прямой и обратной реакций определяются выражениями:
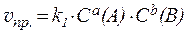
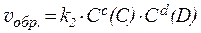
где k1 и k2 - константы скоростей прямой и обратной реакций.
Необходимо отметить, что данное определение справедливо только для простых реакций, протекающих в результате одного элементарного акта взаимодействия частиц.
Уравнения, выражающие зависимость скорости химических реакций от концентраций реагентов, называют кинетическими.
Коэффициент пропорциональности k называют константой скорости химической реакции.
Величина k зависит от природы реагирующих веществ, температуры, наличия катализатора и не зависит от концентрации реагирующих веществ. Физический смысл константы скорости реакции заключается в следующем: она равна скорости реакции в случае, если концентрации всех реагирующих веществ равны и составляют 1 моль/л или их произведение равно 1.
Например:
H2(газ) + I2(газ) ⇄ 2HI(газ)
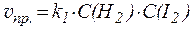 ;
;
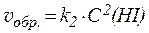 .
.
Если система гетерогенна, то концентрация твёрдой фазы в кинетическом уравнении входит в значение константы скорости (т.е., в явном виде в уравнении не присутствует):
S(тв) + O2(газ) ⇄ SO2(газ)
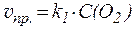 ;
;
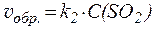 .
.
Зависимость скорости реакции от температуры
При повышении температуры скорость реакции, увеличивается. Эта закономерность в первом приближении может быть выражена уравнением:
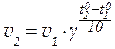 | (23) |
где 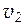 и
и 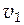 - скорости реакций при температурах
- скорости реакций при температурах 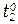 и
и 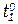 ;
;
γ - температурный коэффициент скорости реакции (темпера-турный коэффициент Вант-Гоффа), который показывает во сколько раз возрастает скорость данной реакции при повышении температуры на 100.
Для большинства реакций g = 2-4. В таких случаях выполняется правило Вант-Гоффа:
При повышении температуры на каждые 100 скорость химической реакции возрастает в 2-4 раза.
Для ферментативных процессов, протекающих в биосистемах, g больше 4 (обычно около 7).
Пример 3.Определить, во сколько раз снижается скорость реакции окисления глюкозы при гипотермии, если температура тела падает от 36,6 до 31,60С, а температурный коэффициент g равен 14.
Решение.
По правилу Вант-Гоффа:
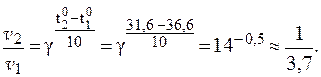
Таким образом, скорость реакции снизилась почти в 4 раза.
В эмпирическом правиле Вант-Гоффа не отражена зависимость самого температурного коэффициента g от температуры. К тому же имеются реакции, для которых значение g выходит за пределы обозначенной области. В связи с этим правило Вант-Гоффа имеет ограниченное применение и предназначено для приблизительной оценки влияния температуры на скорость реакции.
Более точно температурную зависимость скорости химической реакции отражает уравнение Аррениуса. Согласно Аррениусу, константа скорости реакции зависит от температуры следующим образом:
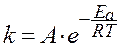 , , | (24) |
где: k - константа скорости реакции;
А - константа Аррениуса, частотный фактор, отражающий число столкновений между реагирующими молекулами в единице объёма в единицу времени;
R - универсальная газовая постоянная (8,31·Дж/(моль×K));
T - температура по Кельвину (273 + t0С);
Ea - энергия активации, кДж/моль.
Энергия активации
Химическое взаимодействие, как правило, начинается с разрыва или ослабления связи между атомами в молекулах реагирующих веществ. Необходимым этапом многих химических превращений является столкновение молекул. Однако подсчёт числа столкновений, выполненный при помощи кинетической теории, показал, что далеко не каждое столкновение ведет к реакции. Так, в реакции разложения йодоводорода, протекающей при комнатной температуре, эффективным (т.е., приводящим к химической реакции) является лишь одно столкновение из 2×1017 столкновений молекул.
Такое соотношение между числом эффективных столкновений и общим числом столкновений объясняется тем, что в ходе взаимодействия частиц образуется неустойчивое промежуточное состояние, которое называется активированным комплексом.
Образование активированного комплекса всегда требует затраты некоторого количества энергии, что вызвано, во-первых, отталкиванием электронных оболочек и атомных ядер при сближении частиц и, во-вторых, необходимостью построения определённой пространственной конфигурации атомов в активированном комплексе и перераспределения электронной плотности. Таким образом, по пути из начального состояния в конечное система должна преодолеть своего рода энергетический барьер. Энергия активации (Ea)реакции приближённо равна превышению средней энергии активированного комплекса над средним уровнем энергии реагентов. Неустойчивый активированный комплекс существует очень короткое время и распадается с образованием продуктов реакции и выделением энергии.
Энергией активации (Ea, кДж/моль) называют дополнительное количество энергии, которое необходимо сообщить 1 моль веществ реакционной массы для начала реакции.
В большинстве случаев энергия активации химических реакций между нейтральными молекулами составляет от 80 до 240 кДж/моль. Для биохимических процессов значения Еа ниже: до 20 кДж/моль. Это объясняется тем, что абсолютное большинство биохимических процессов протекает через стадию фермент-субстратных комплексов.
Энергетические барьеры ограничивают протекание реакции, поэтому в принципе возможные реакции (для которых DGр-я < 0) могут протекать крайне медленно или не протекать вообще.
На рис. 2 представлена энергетическая диаграмма условной реакции, протекающей по уравнению A + B = AB.
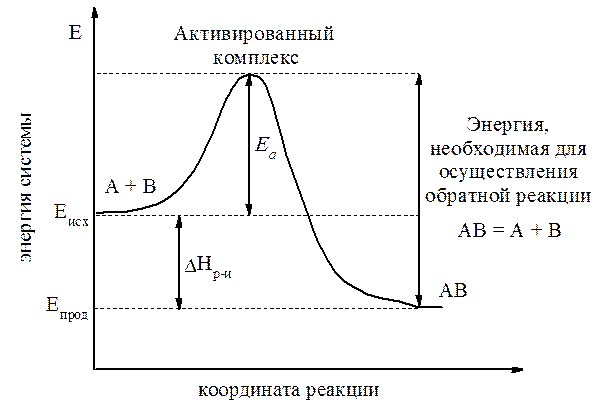
Рис. 2. Энергетическая диаграмма реакции A + B = AB.
где Eисх - средняя энергия частиц исходных веществ;
Eпрод - средняя энергия частиц продуктов реакции;
Ea - энергия активации;
| DHр-я - энергетический эффект (энтальпия) реакции. |
Данная диаграмма позволяет объяснить влияние температуры и концентраций на скорость реакции. Действительно, поскольку температура есть мера средней кинетической энергии частиц, повышение температуры приводит к увеличению доли частиц, энергия которых равна или больше энергии активации, что приводит к увеличению константы скорости реакции. Повышение концентрации также приводит к увеличению числа частиц с более высокой энергией.
Энергия активации зависит от природы реагирующих веществ и в некоторой степени от температуры.
Если энергия активации мала (меньше 40 кДж/моль), скорость реакции велика. Так, ионные реакции в растворах протекают практически мгновенно.
Если энергия активации реакции велика (больше 120 кДж/моль), скорость реакции мала. Например, синтез йодоводорода из I2 и H2 (Еа = 163 кДж/моль) при обычных условиях протекает за астрономический промежуток времени.
Реакции, энергия активации которых находится в пределах от 40 до 120 кДж/моль, протекают за время, которое можно зафиксировать в лабораторных условиях. Так, время протекания реакции разложения тиосульфата натрия серной кислотой, Еа = 86,5 кДж/моль:
Na2S2O3 + H2SO4 = Na2SO4 + S + SO2 + H2O
составляет несколько минут.
