Дослід №1. Складання різних гальванічних елементів
Ni/NiSO4//CuSO4/Сu Zn/Zn SO4//CuSO4/Сu
Cd/CdSO4//CuSO4/Сu Zn/ZnSO4//NiSO4/Ni
Студенти, що працюють за одним столом, збирають один гальванічний елемент. Для цього в склянки наливають відповідні розчини і закривають їх кришкою, в яку вставляють електроди і електролітичний місток. Кожен електрод занурений у розчин своєї солі. Електроди підключають до вольтметра і відзначають його показання. Записати рівняння анодного і катодного процесів і розрахувати значення ЕРС, використовуючи таблицю стандартних електродних потенціалів. Порівняти теоретичне значення ЕРС з експериментальним. Записати рівняння електродних процесів для інших гальванічних елементів, розрахувати ЕРС.
_____________________
_____________________
__________________________________________
_____________________
Таблиця 12
| Гальванічний елемент | Значення ЕРС | Похибка, % | |
| теоретичне | експериментальне | ||
Дослід № 2. Визначити напрямок окисно-відновної реакції:
Сr(NО3)3 + К2SО4 + I2 + H2O = К2Сr2О7 + КI + Н2SО4 + КNО3
А) Внести в пробірку по 2 краплі хром (III) нітрату і калій сульфату і додати до них 1 – 2 краплі йодної води. Чи відбувається окиснення хрому (III) йодом, що повинно супроводжуватися знебарвленням йоду?
_____________________
_____________________
_____________________
_____________________
_____________________
Б) В іншу пробірку внести по декілька крапель розчину калій дихромату і сульфатної кислоти, потім додати 3 – 4 краплі калій йодиду. Чому розчин забарвився в коричневий колір? У прямому чи зворотному напрямку протікає дана окисно-відновна реакція?
_____________________
_____________________
_____________________
_____________________
Контрольні питання та вправи
1. Що називається гальванічним елементом?
2. За яким принципом записують схему гальванічного елемента?
3. Що називається стандартним електродним потенціалом?
4. Як обчислити електродний потенціал металевого електроду?
5. Який електрод у гальванічному елементі є анодом і які реакції на ньому протікають?
6. Який електрод у гальванічному елементі є катодом і які реакції на ньому протікають?
7. Як обчислити електрорушійні силу (ЕРС) гальванічного елемента?
8. Як за схемою гальванічного елемента написати рівняння реакції? Наведіть приклади.
9. Як за рівнянням реакції написати схему гальванічного елемента? Наведіть приклади10. Складіть схеми двох гальванічних елементів, в одному з яких мідь служила би катодом, а в іншому – анодом. Напишіть рівняння реакцій, що відбуваються при роботі цих елементів, і обчисліть значення ЕРС.
11. Обчисліть електродні потенціали магнію в розчині його солі при концентраціях йона Мg2+ 0,1; 0,01 і 0,001 моль/л.
12. 1) З вказаних металів запропонуйте гальванічний елемент з максимальною ЕРС. 2) Запишіть процеси, які відбуваються на електродах. 3) Обчисліть значення ЕРС за стандартних умов. 4) Обчисліть значення ЕРС при умові, якщо анод занурений у розчин з молярною концентрацією солі 0,01 моль/л, а катод – у розчин з молярною концентрацією солі 0,001 моль/л.
| № | Метали | № | Метали | № | Метали | № | Метали |
| Li, Al, Pb, Co | Al, Cs, Ni, Pb | Ag, Mn, Fe, Ca | Al, Mg, Fe,Ti | ||||
| Ba, Ag, Pb, Sn | K, Co, Ca, Pt | Mg, Mn, Cu, K | Hg, Mn, Cd, Li | ||||
| Hg, Mn, Fe, Ca | Bi, Na, Cr, Cu | Ni, Pb, Pt, Sn | V, Fe, Zn, Sb | ||||
| Zn, Fe, Mo, Ni | Ca, Co, Cu, Cd | Ba, Bi, Mg, Ag | K, Bi, Mn, Ag | ||||
| Rb, Cu, Pb, Pt | V, Sb, Tl, Ag | Co, Cu, K, Au | Cs, Ca, K, Al |
Лабораторна робота № 8
ЕЛЕКТРОЛІЗ
Теоретична частина. Електроліз – сукупність окисно-відновних процесів, що протікають на поверхні електродів при проходженні постійного електричного струму через розплав чи розчин електроліту.Електрод, на якому при електролізі відбувається процес відновлення, називається катодом, а на якому відбувається процес окиснення,– анодом. На електроліз впливає матеріал електродів і склад електроліту. Тому необхідно розглядати окремо процеси електролізу розплавів і розчинів, а також процеси електролізу з інертним і розчинним анодами. Інертні аноди виготовляють із платини, іридію або їх сплавів, а також із графіту або вугілля. У процесі електролізу вони не розчиняються. Найпростішим прикладом є електроліз розплаву натрій хлориду:
NaCl ⇄ Na+ + Cl–
(–) на катоді: Na 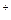 + ē = Na (+) на аноді: 2Cl– – 2ē = Cl2
+ ē = Na (+) на аноді: 2Cl– – 2ē = Cl2
На катоді відбувається відновлення окисників у порядку зменшення їх електродних потенціалів. При цьому на катоді можливі три випадки:
1. Першими на катоді відновлюються окисники, у яких електродні потенціали вищі, ніж потенціал водневого електрода. Це, наприклад, йони Au+, Ag+, Cu2+, йони платинових металів. Відновлення відбувається за схемою: Mez++ zē =Me.
2. На катоді йде розрядка катіонів металів, потенціал яких нижчий, ніж у водневого електрода, але виший, ніж у алюмінієвого (від Mn2+ до Sn2+). Одночасно з ними можливе відновлення йонів Гідрогену (в кислому середовищі) 2Н+ + 2ē = Н2
і відновлення молекул води (в нейтральному і лужному середовищі)
2Н2О + 2ē = 2ОН– + Н2
3. Катіони металів, у яких потенціали нижчі, ніж у алюмінію (від Li+ до Al3+) із водних розчинів на катоді не відновлюються. Замість них відновлюються молекули води: 2Н2О + 2ē = 2ОН– + Н2
Характер реакцій на аноді залежить від присутності води, pH середовища і матеріалу анода.
У водних розчинах електролітів на інертному аноді спочатку окиснюються найбільш сильні відновники, тобто речовини з найменшим електродним потенціалом, наприклад, сульфід-йон, галогенід-йони та ін. Потім у лужному середовищі окиснюються гідроксид-йони:
4ОН– = О2 + 2Н2О + 4ē Е0 = 0,401 В;
у кислому або нейтральному середовищі окиснюються молекули води, якщо в розчині є оксигенвмісні аніони SO42–, NO3–, ClO3–, PO43–: 2H2O = O2 + 4H+ + 4ē E0 = 1,228 B
Послідовність окиснення аніонів і молекул на інертному аноді можна показати у вигляді такого ряду:
| S2-, I-, Br-, Cl-, OH-, H2O | SO 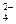 , NO , NO 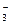 , ClO , ClO 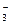 , PO , PO  |
| у водних розчинах не окиснюються |
При проведенні електролізу з активним анодом матеріал аноду розчиняється: Me = Mez+ + zē
Кількісно процеси електролізу визначаються законом Фарадея: маса електроліту, що піддалася перетворенню при електролізі, а також маси речовин, що утворяться на електродах, прямо пропорційні кількості електрики, що пройшла через розчин чи розплав електроліту, і молярним масам еквівалентів відповідних речовин. Закон Фарадея виражається наступним рівнянням:
m = ME I t/F,
де m – маса речовини, що утворилася чи піддалася перетворенню; ME – її молярна маса еквівалентів; I – сила струму; t – час; F – стала Фарадея (96485 Кл/моль), тобто кількість електрики, необхідна для здійснення електрохімічного перетворення одного молю еквівалентів речовини.
