Теоретические основы метода. Электролиз
Электролизом называются химические превращения веществ под действием электрического тока. Для электролиза необходимо, чтобы на электродах были достигнуты потенциалы разряда ионов, находящихся в растворе электролита. Тогда на катоде протекают процессы восстановления
Men+ + ne ® Me0
на аноде - процессы окисления
Me0 - ne ® Men+.
При протекании постоянного электрического тока через электрохимические системы на электродах возникают электрохимические реакции. Соотношение между количеством электричества и массами прореагировавших веществ устанавливается законами Фарадея.
1-й закон. Масса m вещества, претерпевшего химическое превращение под действием электрического тока, пропорциональна количеству протекшего электричества q:
m =keq,
где ke - электрохимический эквивалент равный массе прореагировавшего вещества при протекании единицы количества электричества, г/Кл; г/А ч.
2-й закон. При прохождении через различные электролиты одного и того же количества электричества массы разных веществ, участвующих в электродных реакциях, пропорциональны их молярным массам эквивалентов (Мэкв).
Из второго закона следует, что для электрохимического превращения 1 моль-экв любого вещества требуется одинаковое количество электричества F, называемое постоянной Фарадея. Оно составляет 96 485 Кл/моль-экв, или 26.8 А ч/моль-экв.
Уравнение, объединяющее оба закона Фарадея:
m = (Me/F)Q =MIt/(zF), (1)
где М - молярная масса вещества; I - сила тока, А; t - время процесса, с; z - число электронов, участвующих в электрохимической реакции, F - число Фарадея.
Законы Фарадея являются общими и точными законами электрохимии. Однако при электрохимических процессах часто наблюдаются отклонения от этих законов: масса mпракт действительно полученного или разложившегося продукта не соответствует теоретической mтеор. Эти отклонения - кажущиеся и возникают за счет одновременного протекания побочных электрохимических процессов, химических реакций, в которые вступает продукт, и его потерь.
Так, например, при электролизе ZnCl2 на катоде выделяется Zn:
Zn2+ + 2e - Zn0¯.
При прохождении через раствор количества электричества, равного одному Фарадею, на катоде должен выделится один эквивалент цинка (32.7 г). В действительности цинка на катоде выделяется меньше. Это обусловлено тем, что на катоде, помимо выделения цинка, может идти выделение водорода в результате электролиза воды:
2Н2О + 2е ® Н2 + 2ОН-
или разряд растворенного в воде кислорода:
О2 + 2Н2О + 4е ® 4ОН-.
Так как на осуществление этих реакций тратится какое-то количество электричества, на процесс выделения цинка его остается меньше, чем один Фарадей. В результате цинка на катоде выделяется меньше одного эквивалента.
Подобные отклонения обусловлены совместным разрядом ионов. Но отклонения от законов Фарадея могут возникнуть и тогда, когда продукты электролиза, выделившиеся на электродах, частично растворяются. Поэтому для оценки эффективности электрохимического процесса используется величина, называемая «выход по току» и рассчитываемая по формуле
А = mпракт /mтеор *100%,
где А - выход по току, %; mпракт - масса вещества, выделившегося на электроде в процессе электролиза, г; mтеор - масса вещества, которая должна выделиться на электроде теоретически, г.
Кулонометрический анализ.
Кулонометрия основана на законах Фарадея, устанавливающих связь между количеством электричества, прошедшего через раствор электролита, и массой вещества, выделившегося на электроде в результате электрохимической реакции.
В зависимости от происходящих в растворе электрохимических процессов различают прямую кулонометрию и кулонометрическое титрование. В первом случае определяют электрохимическиактивное вещество, которое осаждают (или переводят в новую степень окисления) на электроде при заданном потенциале электролиза, при этом затраченное количество электричества пропорционально количеству прореагировавшего вещества. Во втором случае в анализируемый раствор вводят электрохимически активный вспомогательный реагент, который количественно химически взаимодействует с определяемым веществом. Содержание определяемого компонента оценивают по количеству электричества, прошедшего через раствор вплоть до момента завершения химической реакции, который устанавливают, например, с помощью цветныхиндикаторов. Прямая кулонометрия, в свою очередь, подразделяется на потенциостатическую кулонометрию и амперостатическую кулонометрию. В первом случае анализ выполняется при поддержании постоянного значения потенциала рабочего электрода, во втором - при постоянной величине тока.
Потенциостатическая кулонометрия. Каждый ион, участвующий в электрохимической реакции, выделится на электроде только в том случае, если достигнут потенциал его разряда. На рис. представлена вольтамперная кривая для многокомпонентной системы. При значении потенциала электрода j1 начинается разряд одного из компонентов раствора, потенциал j2 соответствует началу разряда второго компонента. При потенциале j3 начинает разряжаться третий компонент. Таким образом, устанавливая то или иное значение потенциала электрода, можно добиться, чтобы на рабочем электроде выделялся определенный ион.
Потенциостатическая кулонометрия основана на измерении количества электричества, пошедшего на электрохимическое восстановление или окисление определяемого вещества при постоянном значении потенциала рабочего электрода. Чтобы процесс шел с максимальной скоростью и 100% выходом по току, электролиз следует проводить при потенциале, соответствующем средине площадки предельного тока диффузии определяемого вещества. Для первого компонента этот потенциал соответствует j1’.
 |
Рис. Вольтамперная кривая многокомпонентной системы
По мере восстановления или окисления на электродах определяемого иона его концентрация в растворе уменьшается и сила тока в цепи падает. Общее количество электричества, затраченное на полное электрохимическое превращение определяемого иона, выражается площадью, ограниченной кривой в координатах «сила тока - время» (рис. а) и рассчитывается по формуле
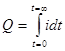
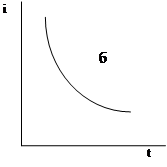 |  | ||||
 | |||||
Рис. Зависимость силы тока от времени электролиза: а) - теоретическая кривая ток-время в потенциостатических условиях; б) - кинетическая кривая в потенциостатических условиях; в) - кинетическая кривая в полулогарифмических координатах
Для полного электрохимического превращения вещества нужно бесконечно большое время, т.к. i® 0 при t® ¥ . Поэтому для практических целей величину тока в любой момент времени можно определить по уравнению
it= i0·e-kt, (1)
где it- величина тока к моменту времени t, А; i0 - ток в момент начала электролиза, А; k- константа, зависящая от условий электролиза, с-1. В соответствии с уравнением (1), уменьшение тока идет по экспоненциальной кривой (рис. б).
Прологарифмировав уравнение (1), получим:
lnit = lni0 - kt (2)
Полученное выражение представляет собой прямую линию, точка пересечения которой с осью ординат соответствует lni0, а тангенс угла ее наклона - k. Определив значение k, количество электричества находят по формуле
Q = i0/k. (3)
Содержание определяемого вещества находят по закону Фарадея.
Преимуществом потенциостатической кулонометрии является высокая селективность метода, т.е. возможность поочередного определения веществ в их смеси.
Амперостатическая кулонометрия. Основана на определении количества электричества, затраченного на электрохимические превращения определяемого вещества при постоянном значении тока, протекающего через электролитическую ячейку. Поскольку определение содержащегося в растворе вещества при этом методе проводят при постоянном значении силы тока, то определив время электролиза, можно рассчитать количество электричества по формуле
Q = it.
Однако в практике проведения анализа есть сложности. В процессе электролиза по мере уменьшения концентрации анализируемого вещества изменяется потенциал рабочего электрода и появляется возможность разряда другого компонента раствора. Следовательно, будут происходить затраты электричества на побочные электрохимические процессы (выход по току для определяемого вещества будет меньше 100%). Чтобы избежать этого, принимаются специальные меры. Например, в исследуемый раствор вводится вспомогательный реагент, который участвует в электрохимической реакции, а продукт этой реакции должен стехиометрически взаимодействовать с определяемым веществом.
Из законов Фарадея следует, что количество электричества, прошедшее через раствор электролита, может быть определено по массе продуктов электролиза, выделившихся на электроде при прохождении тока. Для определения количества электричества, протекшего через раствор электролита, используется кулонометр.
Кулонометр представляет собой электрохимическую ячейку, в которой протекает хорошо изученная реакция со 100% выходом по току. Принцип действия кулонометра основан на том, что его включают в электрическую цепь последовательно с электрохимической ячейкой, в которую залит анализируемый раствор. Таким образом, за некоторый промежуток времени через анализируемый раствор и через кулонометр пройдет одно и то же количество электричества. Поскольку в кулонометре проходит известная электрохимическая реакция (например Cu2+ + 2e - Cu0), то измерение количества электричества сводится к определению массы вещества, выделившегося на катоде кулонометра, и расчету с использованием формулы:
Q = it = mF/Me.
В зависимости от способа измерения различают электрогравиметрические, титрационные и электронные кулонометры. В электрогравиметрических кулонометрах определяют массу выделившегося на электроде вещества. Электронный кулонометр непосредственно отсчитывает число кулонов.
Кулонометрию используют для определения как следовых (на уровне 10-9-10-8 моль/л), так и весьма больших количеств веществ с высокой точностью. Кулонометрически можно определять многие неорганические (практически все металлы, в том числе тяжелые, галогены, S, NO3-, NO2-) и ароматические вещества (ароматические амины, нитро- и нитрозо-соединения, фенолы).
