Ненасичені альдегіди і кетони
Лекція 6.
Альдегіди та кетони
1. Загальна характеристика альдегідів
2. Загальна характеристика кетонів
3. Номенклатура та ізомерія альдегідів
4. Номенклатура та ізомерія кетонів
5. Способи добування альдегідів, кетонів
6. Фізичні та хімічні властивості альдегідів, кетонів
7. Застосування альдегідів, кетонів
До альдегідів і кетонів належать органічні сполуки, які містять у своєму складі карбонільну (оксо) групу >С=О. Тому ці сполуки ще називають оксосполуками або карбонільними. Вони утворюють гомологічні ряди, де кожний наступний член відрізняється від попереднього на гомологічну різницю –СН2. У альдегідів атом карбону карбонільної групи зв’язаний з одним атомом гідрогену і одним вуглеводневим радикалом. У кетонах атом карбону карбонільної групи зв’язаний з двома вуглеводневими радикалами. Загальна формула альдегідів і кетонів:
 ,
, 
альдегід кетон.
Класифікація Альдегіди та кетони поділяють на ациклічні (насичені та ненасичені) та циклічні (похідні циклоалканів, аренів, терпенів). За кількістю функціональних груп розрізняють моно-, ди- та полікарбонільні сполуки (залежно від кількості оксогруп):
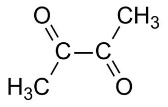



оцтовий альдегід ацетон гліоксаль діацетил
Номенклатура. За раціональною номенклатурою назви альдегідів утворюють від назви тієї ж кислоти, в яку вони переходять при окисленні:
 |  |
| оцтовий альдегід | пропіоновий альдегід і т.д. |
Назви кетонів утворюють від назв радикалів, які сполучені з карбонільною групою, з додаванням слова кетон. Так, найпростіший кетон називають диметилкетоном, наступний метилетилкетоном і т.д.:
 |  |
| диметилкетон | метилетилкетон |
За систематичною номенклатурою назви альдегідів і кетонів виводять від назв відповідних вуглеводнів, додаючи до них закінчення -аль (альдегіди) або -он (кетони) з позначенням номера того вуглеводневого атома, який є карбонільним. Нумерацію карбонового ланцюга починають з того кінця, до якого ближче розміщена функціанальна група. Якщо функціональна група сполучена з атомом Карбону циклічної структури, до назви останньої додають закінчення – карбальдегід. Вийнятнком э найпростыший ароматичний альдегід – бензальдегід. Наприклад:
 |  |  |  |
| пропаналь | 2-метилпропаналь | бутанон-2 | 2-метилпентанон-3 |
Ізомерія. Ізомерія альдегідів залежить від ізомерії ланцюга радикала:
 |  |
| бутаналь | ізобутаналь |
Ізомерія кетонів залежить від положення карбонільної групи в ланцюгу, а також від ізомерії самого ланцюга в радикалах, наприклад:
 |  |  |
| метилізопропілкетон | діетилкетон | метилпропілкетон |
Альдегіди і кетони з однаковою кількістю атомів карбону ізомерні одні одним.
Способи добування.
1. Гідроліз дигалогенопохідних. При нагріванні дигалогенопохідних вуглеводнів, які містять обидва атоми галогену при одному й тому ж атомі карбону, з водою або краще з лугом відбувається утворення альдегідів або кетонів. Якщо атоми галогену розташовані біля крайнього атома Карбону, утворюються альдегіди, в інших випадках – кетони:
 .
.
2. Окислення спиртів. Можна добувати окисленням відповідних спиртів. При окисленні первинних спиртів утворюються альдегіди, а при окисленні вторинних – кетони. Окислення можна проводити за допомогою оксигену повітря в присутності каталізаторів (платини, міді); у лабораторії окислення звичайно здійснюють за допомогою калій біхромату або марганець діоксиду і сульфатної кислоти.
 .
.
Вторинні спирти при дії окислювачів переходять у кетони:
 .
.
3. Дегідрування спиртів. У промисловості широко застосовують дегідрування первинних і вторинних спиртів.
 ,
,  .
.
4. Піроліз солей карбонових кислот. При сухій перегонці кальцієвих або барієвих солей аліфатичних кислот (крім солей мурашиної кислоти) утворюються кетони з двома однаковими радикалами, наприклад:
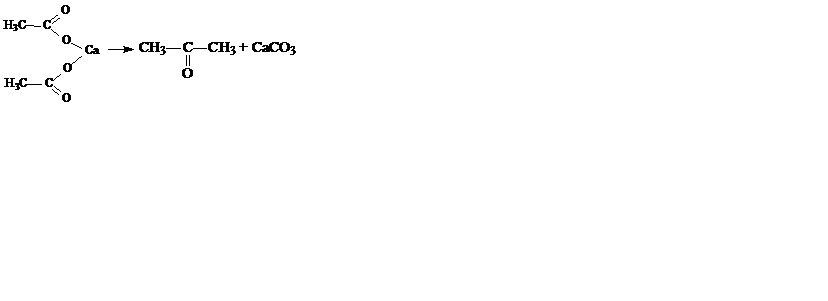 .
.
Для добування кетонів з різними радикалами беруть солі відповідних карбонових кислот, які містять потрібні радикали:

Якщо взяти суміш солей двох кислот, з яких одна є сіллю мурашиної кислоти, то утворюється альдегід.
5. Гідратація ацетилену та його похідних. Альдегіди і кетони можна одержати за реакцією М.Г. Кучерова гідратацією ацетилену та його похідних.
6. За реакцією Гріньяра. Альдегіди можуть бути добуті дією реактива Гріньяра на ефір мурашиної кислоти:
 Кетони добуваються дією магнійорганічних сполук на нітрили. При цьому, як проміжні продукти, утворюються іміди, які легко гідролізуються водою або розведеними кислотами:
Кетони добуваються дією магнійорганічних сполук на нітрили. При цьому, як проміжні продукти, утворюються іміди, які легко гідролізуються водою або розведеними кислотами:

7. Оксосинтез. Важливий промисловий спосіб добування альдегідів полягає в безпосередньому приєднанні CO і Н2 до алкенів. Процес відбувається при 100 – 200°С під тиском 100 – 250 ат. у присутності каталізатора (Co+ThO2+MgO нанесених на кізельгур):
 .
.
8. Відновлення карбонових кислот
Зазвичай відновлюють не самі кислоти, а їх похідні (відновлення за Розенмундом)
CH3COCl → CH3COH
Каталізатором є отруєний сіркою паладій, нанесений на барійсульфат.
Фізичні властивості. Перший найпростіший представник альдегідів – метаналь (формальдегід) – газ з різким неприємним запахом, добре розчинний у воді. Наступні представники – рідини. Вищі гомологи – нерозчинні тверді речовини. Нижчі альдегіди мають різкий запах, середні (С3– С8) – мають запах поту, вищі (С9 і більше) запаху не мають.
Нижчі й середні кетони (до С15) – рідини, найпростіші кетони мають характерний не дуже різкий запах, середні гомологи мають досить приємний запах. Вищі кетони – тверді речовини. Найпростіші альдегіди і кетони порівняно легко розчиняються у воді, зі зростанням молекулярної маси розчинність швидко зменшується.
У спирті та ефірі альдегіди і кетони добре розчиняються. Альдегіди і кетони киплять при температурі, яка нижче температури кипіння відповідних спиртів.
Хімічні властивості. Наявність карбонільної групи у альдегідів і кетонів обумовлює їх високу реакційну здатність, причому альдегіди більш реакційноздатні, ніж кетони.
Реакційна здатність карбонільної групи істотно залежить від природи зв’язаних з нею радикалів. Відомо, що з усіх карбонільних сполук найбільш реакційноздатними є альдегіди, а серед них – формальдегід. Карбонільна група в кетонах менш реакційноздатна.
Причини послідовності зниження реакційної здатності карбонільної групи в альдегідах і кетонах порівняно з формальдегідом можна пояснити таким чином.
Для альдегідів і кетонів характерні чотири групи реакції:
1) приєднання за місцем подвійного зв’язку карбонільної групи,
2) заміщення по оксигену карбонільної групи,
3) окислення,
4) полімеризація і конденсація.
І. Реакції приєднання за місцем подвійного зв’язку карбонільної групи.
1. Приєднання гідрогену. Альдегіди і кетони здатні приєднувати атоми гідрогену, причому альдегіди відновлюються в первинні, а кетони – у вторинні спирти:
 .
.
Цю реакцію можна здійснити дією гідрогену в момент виділення або гідрування молекулярним воднем у присутності мідного каталізатора при температурі 180 – 220°С. При застосуванні нікелевого каталізатора відновлення може здійснюватися аж до утворення вуглеводнів.
2. Приєднання синильної кислоти. Зв’язок Н–С у молекулі синильної кислоти поляризований і тому група CN–, яка має деякий негативний заряд, приєднується до карбонільного атома карбону, а гідроген до атома – оксигену. Добуті при цьому сполуки мають назву оксинітрилів (або ціангідридів):
 .
.
Ця реакція відбувається у лужному середовищі. За відсутності основи реакція практично не відбувається. Ця реакція активно використовується для синтезу α-гідроксикислот та α-амінокислот, а також для продовження вуглецевого ланцюга вихідних сполук на один атом.
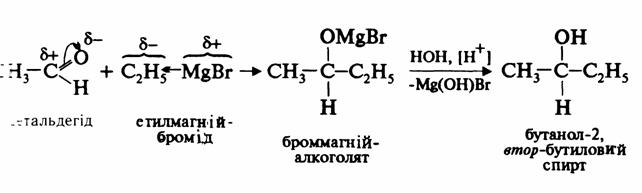
3. Приєднання магнійгалогеналкілів. Альдегіди і кетони здатні приєднувати магнійгалогеналкіли. При розкладі продуктів приєднання водою одержують відповідно вторинні й третинні спирти із більшою кількістю атомів карбону в молекулах.
4. Приєднання гідросульфіту натрію. Альдегіди і кетони легко вступають у реакцію з гідросульфітом натрію, утворюючи так звані бісульфітні сполуки:
 .
.
Із кетонів у цю реакцію вступають лише метилкетони і деякі кетони циклічного ряду, наприклад циклогексанон.
Реакція зворотна, оскільки у разі додавання кислоти або основи утворюються вихідні продукти. Гідросульфітні сполуки – кристалічні речовини, майже нерозчинні у ненасиченому розчині бісульфату натрію, розщеплюються при нагріванні з розчином соди або розведеними кислотами, утворюючи альдегіди або кетони. Ця реакція важлива для цукрової промисловості, оскільки процес сульфітації інгібує утворення кольорових речовин у виробництві цукру необхідної якості. Також ця реакція використовується для виділення та кількісного визначення оксосполук.
5. Реакція з аміаком. При дії аміаку на альдегіди утворюються нестійкі продукти приєднання, які відразу ж дегідратуються і перетворюються на альдіміни:
 .
.
Приєднання аміаку до формальдегіду лежить в основі одержання антисептику уротропіну, або гексаметилентетраміну.Уротропін також використовують для одержання фенопластів, а також як сировину для синтезу вибухових речовин (гексогену).
Кетони з аміаком подібних сполук не утворюють.
6. Реакція з водою.
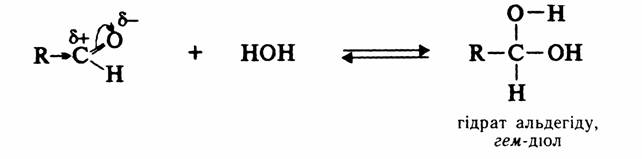
Гідрати – нестійкі сполуки, оскільки біля одного атома карбону знаходиться дві гідроксогрупи. Гідрат швидко втрачає молекулу води і знову перетворюється в альдегід. Гідрати існують в розчині і лише для низькомолекулярних альдегідів. Кетони не здатні утворювати гідрати. При введенні до складу радикалу електроноакцепторних атомів або групи атомів утворюються стійкі гідрати. Наприклад, такою сполукою може бути хлоралгідрат, що використовується в медицині та ветеринарії для наркозу.
II. Реакції заміщення.
1. Дія п’ятихлористого фосфору. При дії п’ятихлористого фосфору атом оксигену в молекулі альдегіду або кетону заміщується двома атомами хлору, при цьому утворюються дигалогенопохідні вуглеводнів з двома атомами галогену при одному атомі карбону.
 ,
,

2. Утворення оксимів і гідразонів. Альдегіди і кетони здатні вступати в реакції з гідроксиламіном, гідразином та його похідними, утворюючи речовини з різними точками плавлення, які добре кристалізуються. Тому ці реакції застосовуються для виділення альдегідів і кетонів і розпізнання їх.
а) При взаємодії альдегідів і кетонів з гідроксиламіном утворюються оксими:
 .
.
Оксими – рідкі або низькоплавкі тверді речовини, добре розчинні у більшості органічних розчинників. Застосовуються для одержання пестицидів (наприклад, бутокароксиму), лікарських засобів, реактивів для хімічних аналізів (диметилгліоксим).
б) При взаємодії альдегідів і кетонів з гідразином утворюються гідразони:
 .
.
Гідразони альдегідів і кетонів під дією твердих гідроксидів або алкоголятів зазнають каталітичного розкладу з виділенням вільного азоту і утворенням вуглеводнів. Ця реакція вперше була відкрита в 1910 p. М.М. Кіжнером і називається реакцією Кіжнера. Вона дає можливість здійснювати перехід від альдегідів і кетонів до відповідних вуглеводнів.
Гідразони – рідкі та тверді речовини, що використовуються для синтезу медикаментів, барвників, ініціаторів полімеризації, як відновники.
в) Альдегіди і кетони взаємодіють з похідними гідразину, утворюючи гідразони. Наприклад, при взаємодії з фенілгідразоном утворюються фенілгідразони:
 .
.
Кристали фенілгідразонів мають певну конфігурацію. Тому можна виділити альдегіди чи кетони у чистому вигляді, або розділити їх суміш на окремі речовини за зовнішнім виглядом кристалів. Фенілгідразони після виділення з сумішей обробляють кислотами, що дозволяє розкласти їх на відповідні альдегіди та кетони.
3. Утворення ацеталей. При нагріванні альдегідів зі спиртами у присутності невеликої кількості безводних мінеральних кислот утворюються ацеталі – прості ефіри двоатомних спиртів:
 .
.
Кетони в цих умовах не утворюють ацеталей. Ацеталі стійкі до дії лугів, але легко гідролізуються при дії розведених кислот, утворюючи вихідні продукти – альдегід і спирт.
4. Заміщення a-гідрогенових атомів на галоген. Карбонільна група сприяє підвищенню активності a-гідрогенових атомів. Тому карбонільні сполуки можуть вступати в реакції, в результаті яких відбувається заміщення a-гідрогенових атомів. Так альдегіди і кетони енергійно реагують з галогенами і утворюють a-галогенозаміщені сполуки. Реакція каталізується кислотами і особливо лугами:

На галогени можуть послідовно заміщуватися всі a-гідрогенові атоми альдегіду або кетону, наприклад:

III. Окислення альдегідів і кетонів. Альдегіди дуже легко окислюються до відповідних кислот з тією ж кількістю атомів карбону, тобто вони є сильними відновниками:
 .
.
Характерною реакцією для альдегідів є реакція срібного дзеркала, тобто окислення їх аміачним розчином оксиду срібла:
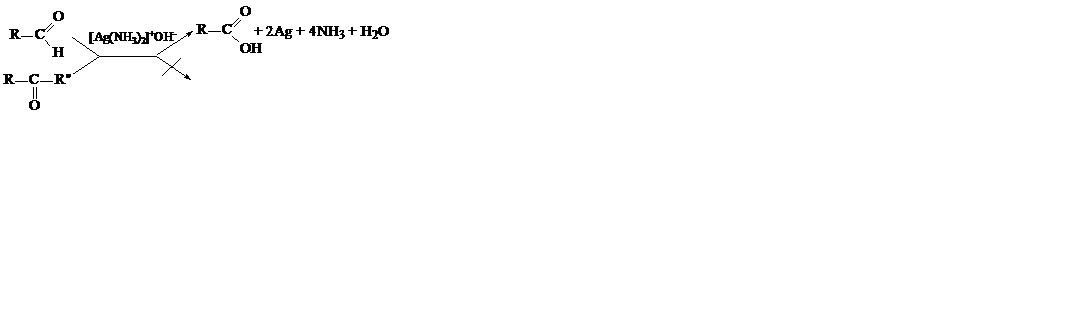 .
.
Аміачний розчин оксиду срібла нагрівають у чистій скляній пробірці з альдегідом, який, легко окислюючись в кислоту, відновлює сполуки срібла до металічного срібла, що виділяється на внутрішніх стінках пробірки у вигляді срібного дзеркала.
Другою характерною для альдегідів реакцією є реакція з фуксинсульфатною кислотою. До 0,1 – 0,2%-ного водного розчину фуксину додають кілька мілілітрів майже насиченого водного розчину сульфатного ангідрину доти, доки після деякого стояння фуксин знебарвиться. Якщо до цього безбарвного розчину фуксинсульфатної кислоти додати розчин альдегіду, рідина зафарбовується в синювато-червоний колір. Обидві ці реакції використовують як якісні для відкриття альдегідів.
Для карбонільних сполук також характерна реакція з фелінговою рідиною. Існують два фелінгові розчини: І – розчин СuSO4 та ІІ, що містить луг (NaOH) та сегнетову сіль, тобто тартрат калію-натрію. У разі змішування І та ІІ розчинів утворюється фелінгова рідина.
Під час взаємодії купрум сульфату з натрій гідроксидом утворюється синій осад купрум гідроксиду:
CuSO4 + 2NaOH → Cu(OH)2 ↓ + Na2SO4
Однак, сегнетова сіль в лужному середовищі розчиняє купрум гідроксид, утворюючи комплексну сполуку і переводе йон Купруму у розчинний стан:
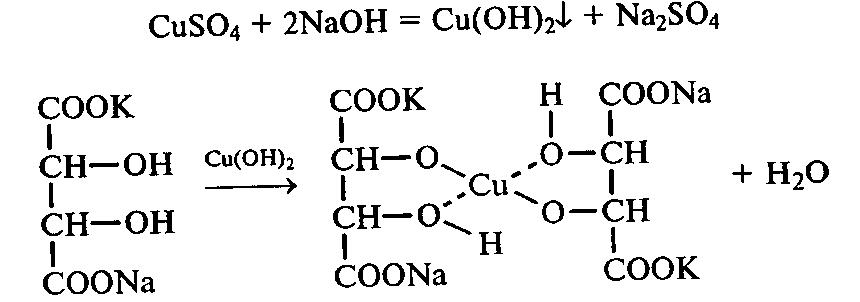
Розчин цієї комплексної сполуки має яскраво-лазурне забарвлення. Під час кип’ятіння фелінгової рідини з оксосполуками Купрум (ІІ) відновлюється до Купрум (І), а альдегід окиснюється до кислоти. Червоний Сu2O випадає в осад. На цьому грунтуються методи Офнера та Мюллера для кількісного визначення вмісту глюкози та фруктози у продуктах цукрового виробництва.
Кетони на відміну від альдегідів не вступають у реакцію срібного дзеркала і окислюються лише під дією сильних окислювачів, наприклад хромової суміші або КМnO4. При цьому відбувається розрив карбонових атомів біля карбонільного карбону, відповідно до правил Попова, які були сформульовані у 1876 році, а далі розвинені в роботах Є.Є. Вагнера. Згідно з цими правилами дія окислювача напрямлена на один з a-карбонових атомів. При цьому утворюється оксикетон, який далі перетворюється на a-дикетон. Подальша дія окислювача викликає розрив зв’язку між карбонільними групами в молекулі a-дикетону і призводить до утворення карбонових кислот. Оскільки окислення a-карбонових атомів може відбуватися по обидва боки кетонної групи, то в результаті утворюється суміш карбонових кислот, наприклад:
 .
.
Якщо ж окислюється кетон з різними радикалами, то розрив ланцюга може відбуватись у двох напрямках, наприклад:
 .
.
Отже, може утворитися чотири кислоти. Реакція окислення кетонів дає можливість за кислотами, які утворюються, встановити будову кетонів.
9. Реакція Канніцаро. Альдегіди, в молекулах яких немає гідрогену біля a-карбонового атома, у лужному середовищі вступають в окисно-відновну реакцію, в результаті якої одна молекула альдегіду відновлюється до спирту, а інша при цьому окислюється до карбонової кислоти:

Реакція Канніцаро відбувається з гідридним перенесенням гідрогену альдегідної групи.
Кетони в цю реакцію не вступають.
IV. Полімеризація альдегідів.
Альдегіди дуже легко полімеризуються, тобто з кількох однакових молекул альдегіду утворюється одна, яка має той же елементарний склад, але більш високу (кратну) молекулярну масу. Полімеризація альдегідів відбувається двома різними способами – тримолекулярно і полімолекулярно:
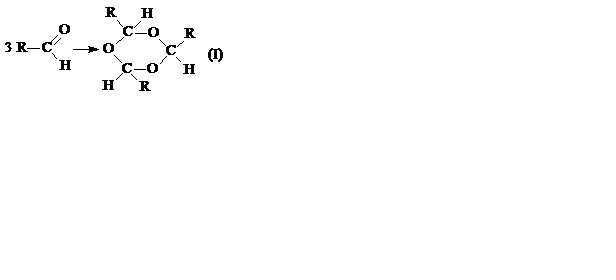 ,
,  .
.
Полімеризація за полімерним механізмом (II) спостерігається лише в перших двох членах гомологічного ряду – мурашиного й оцтового альдегідів. У мурашиного альдегіду переважає процес (II). У оцтового альдегіду – процес (І). Решта альдегідів полімеризується виключно за тримолекулярною схемою (І). Реакція полімеризації альдегідів оборотна, і рівновага її при підвищеній температурі усувається ліворуч (деполімеризація).
До недавнього часу вважали, що кетони не здатні до полімеризації. У 1960 p. В.О. Каргін і співробітники описали одержання полімерів ацетону. Полімеризацію ацетону проводили методом сумісної конденсації молекулярних пучків мономеру та ініціатора (металічного магнію) на дуже охолодженій поверхні. У 1960 p. Натта зі співробітниками повідомив про одержання полімеру диметилкетону і сополімеру диметилкетону з ацетоном і ацетофеноном. Диметилкетон у присутності бромистого алюмінію або триетилалюмінію утворює регулярний полімер, вірніше, співполімер двох форм мономерного диметилкетену. Отже, полімеризація відбувається як за вінільним, так і за карбонільним зв’язком мономеру.
V. Конденсація альдегідів і кетонів.
1. Альдольна і кротонова конденсації. Під впливом розведених розчинів лугів протікає реакція конденсації двох молекул альдегіду, або альдегіду і кетону, або двох молекул кетону в одну складну молекулу, яка містить в собі одночасно спиртову й альдегідну або кетонну групи. Наприклад, при ущільненні оцтового альдегіду одержується альдегідалкоголь:
 .
.
Аналогічно при ущільненні ацетону утворюється діацетоновий спирт:
 .
.
Реакцію такого типу називають альдольною конденсацією. Вперше вона була відкрита у 1863 – 1873 pp. російським хіміком О.П. Бородіним, який при конденсації оцтового альдегіду одержав альдоль.
Із добутого альдегідалкоголю легко може виділитися вода, тому що в ньому є гідроксильна група, яка розміщується біля атома карбону, суміжного з атомом карбону, при якому є гідрогенові атоми, що мають високу активність:
 .
.
Аналогічно з 2-метилпентанол-2-он-4 утворюється оксид мезитилу:
 .
.
Реакцію такого типу називають кротоновою конденсацією.
В альдольну й кротонову конденсації кетони вступають більш повільно, ніж альдегіди. Як каталізатори використовують агенти основного характеру (СН3СООК, К2СО3, КСN).
2.Складноефірна конденсація В.Є. Тищенка. Під впливом алкоголяту алюмінію дві молекули альдегіду утворюють молекулу складного ефіру:
 .
.
Характерні особливості альдегідів і кетонів. Між альдегідами і кетонами існує ряд істотних відмінностей:
1. Альдегіди більш реакційноздатні ніж кетони;
2. Альдегіди легко окиснюються без зміни карбонового ланцюга, кетони окиснюються важко з розривом ланцюга;
3. Альдегіди полімеризуються під впливом кислот, кетони – ні;
4. Альдегіди утворюють альдегідоамоніаки, кетони – ні;
5. Альдегіди за наявності кислот утворюють ацеталі, кетони – ні;
6. Альдегіди утворюють забарвлення з фуксинсульфітною кислотою, кетони – ні.
Застосування.
Мурашиний альдегід (формальдегід, метаналь) – за звичайних умов безбарвний газ з різким специфічним запахом, добре розчиний у воді. 40%-ний водний розчин мурашиного альдегіду, що містить 5-15% метанолу для стабілізації, називається формаліном. Мурашиний альдегід отруйний і навіть при малих концентраціях у повітрі подразливо діє на слизові оболонки.
Формальдегід у промисловості добувають каталітичним окисненням метанолу, пропускаючи його пари в суміші з повітрям через контактний апарат з розжареною мідною спіраллю. Часто формальдегід одержують шляхом неповного окиснення метану киснем повітря в присутності каталізатора (сполук марганцю та міді) при високих температурах.
За хімічними властивостями мурашиний альдегід помітно відрізняється від інших альдегідів. При нагріванні з лугами більшість альдегідів аліфатичного ряду осмолюються, мурашиний альдегід при дії концентрованого розчину лугу утворює метиловий спирт і мурашину кислоту.
При звичайній температурі мурашиний альдегід легко полімеризується, причому утворюється білий порошок пароформальдегіду. Пароформальдегід вперше добув і дослідив О.М. Бутлеров.
Пароформальдегід утворюється при концентруванні водних розчинів мурашиного альдегіду, а також при тривалому стоянні, особливо при зберіганні при низькій температурі.
Формальдегід у вигляді формаліну або полімерів застосовується в органічному синтезі, консервування анатомічних препаратів, протравлення насіння перед посівом та ін. Для дезінфекції тваринницьких приміщень використовують різні концентрації формаліну: 1% розчин – при пастерельозі, ящурі, бешисі свиней; 2% – паратифі і чумі свиней; 4% – при боротьбі з сибіркою. Значна кількість його йде на добування фенолоформальдегідних смол, які застосовуються у виробництві різноманітних виробів із пластмас, для виготовлення підошовної шкіри і непромокальної тканини. Широко використовується формалін також у цукровому виробництві для боротьби з мікробною інфекцією, особливо під час екстракції цукру з бурякової стружки.
Оцтовий альдегід (ацетальдегід, етаналь). Оцтовий альдегід надзвичайно летка рідина з різким запахом прілих яблук або зеленого листя. Змішується в усіх відношеннях з водою і спиртом. Отруйний.
Його добувають за допомогою реакції Кучерова, дегідруванням етанолу, окисненням етилену.
Під впливом невеликої кількості сульфатної кислоти легко полімеризується в паральдегід. При дії сульфатної кислоти на оцтовий альдегід при низькій температурі утворюється полімер – кристалічний метальдегід. При нагріванні обох полімерів у присутності навіть однієї краплі сульфатної кислоти відбувається повна деполімеризація в ацетальдегід. Оцтовий альдегід застосовують для добування оцтової і молочної кислот, кротонового альдегіду, етилацетату та багатьох інших хімічних продуктів.
Хлораль (трихлороцтовий альдегід) є найважливішим представником галогенальдегідів. Хлораль – безбарвна рідина з різким запахом. Під впливом кислих каталізаторів легко полімеризується, утворюючи твердий аморфний полімер метахлораль. Використовувався для добування ДДТ – (1,1,1-трихлор-2,2-ді (п-хлорфеніл) етан за номенклатурою ІЮПАК, за раціональною номенклатурою – трихлорметилди (п-хлорфеніл) метан) – інсектицид, що застосовується проти комарів, шкідників бавовни, соєвих бобів, арахісу. Одне з небагатьох дійсно ефективних засобів проти сарани. Заборонений для застосування в багатьох країнах через те, що здатний накопичуватися в організмі тварин, людини. Деякі активісти-екологи стверджують, що особливо згубно він впливає на розмноження птахів (накопичується в шкаралупі яєць). Зараз заборонений. Широко поширена побутова назва ДДТ – «дуст» (від англ. Dust - порошок, пил).
Ацетон( диметилкетон,пропанон) найпростіший представник кетонів. Він являє собою безбарвну рідину, яка змішується в усіх співвідношеннях з водою, спиртами, ефірами, мінеральними маслами і рослинними оліями, бензином, скипидаром, має специфічний запах. Сам ацетон є відмінним розчинником. Ацетон у великій кількості використовують як розчинник у лакофарбовій промисловості, у виробництві кіноплівок, штучного шовку, бездимного пороху, целулоїду, широко застосовують для добування багатьох цінних органічних речовин – ізопрену, ізоферону, хлороформу, йодоформу, сульфоналу та ін. Здатність ацетону розчиняти ацетилен широко використовується при наповненні стальних балонів, в яких зберігається ацетилен.
НЕНАСИЧЕНІ АЛЬДЕГІДИ І КЕТОНИ
Найпростішим представником ненасичених альдегідів є акролеїн, кетонів – метилвінілкетон:
 |  |
| акролеїн | метилвінілкетон |
Ненасичені альдегіди і кетони дають типові реакції як альдегідів або кетонів, так і ненасичених сполук.
Акролеїн добувають у промисловості окисленням пропілену киснем повітря при 260 – 270°С у присутності каталізатора або альдольною конденсацією формальдегіду з оцтовим альдегідом при температурі 300°С у присутності Li3PO4.
Акролеїн – безбарвна летка рідина з надзвичайно різким запахом, легко полімеризується в тверду білу аморфну речовину – дисакрил. Завдяки наявності альдегідної групи і подвійного зв’язку акролеїн надзвичайно реакційноздатний. Легко приєднує галогени, галогеноводні, воду, спирти і аміни. Крім того, вступає в усі реакції, характерні для альдегідів. Акролеїн застосовується для добування метіоніну, глутарового альдегіду 6-валеролактону, гліцеринового альдегіду, алілового спирту, багатьох медикаментів. Невеликі кількості акролеїну утворюються при нагріванні жирів та олій внаслідок розкладання на гліцерин і ВЖК з подальшим окисненням гліцерину та його дегідратацією.
Кротоновий альдегід одержують у промисловості альдольною конденсацією ацетальдегіду в присутності розведених лугів. Кротоновий альдегід – безбарвна рідина з дуже різким запахом, викликає сльозотечу, подібно акролеїну надзвичайно реакційноздатний. Використовують кротоновий альдегід для добування бутилового спирту, масляного альдегіду, малеїнової кислоти й інших продуктів. Кротоновий альдегід додають до природного газу для попередження просочування його в приміщення.
Дивінілкетони. І.М. Назаров установив, що дивінілкетони можна добувати реакцією ізомеризації вінілетинілкарбінолів у присутності солей ртуті як каталізатора. Дивінілкетони можуть бути вихідними речовинами для добування насичених спиртів, кетоноспиртів, кетонокислот та їх ефірів, різних груп аліциклічних, ароматичних та гетероциклічних сполук.
ДІАЛЬДЕГІДИ І ДИКЕТОНИ
До діальдегідів і дикетонів належать органічні сполуки, які містять у своєму складі дві карбонільні групи. Якщо ці групи розміщені на кінцях карбонового ланцюга, то такі сполуки називаються діальдегідами, наприклад:
10.  .
.
У кетонах кожний атом карбону карбонільних груп зв’язаний з двома вуглеводневими радикалами. Дикетони, в яких карбонільні групи сполучені між собою безпосередньо, називаються a-дикетонами; дикетони, в яких карбонільні групи розділені однією метиленовою групою , називаються b-дикетонами; дикетони, в яких карбонільні групи розділені двома метиленовими групами, називаються g-дикетонами і т.д.:
 |  |  |
| a-дикетон | b-дикетон | g-дикетон |
Для найменування діальдегідів та дикетонів особливо зручно користуватися женевською номенклатурою, згідно з якою назви їх утворюють від назв відповідних вуглеводнів, додаючи до назви вуглеводню закінчення -діаль, що характеризує діальдегіди, або закінчення -діон, що характеризує дикетони; місця карбонільних груп у ланцюгу атомів карбону позначають цифрами, наприклад:
 |  |
| бутандіаль | пентандіон-2,4 |
Характерною властивістю усіх діальдегідів є легка полімеризація та здатність до утворення гетероциклічних сполук.
Гліоксаль (деформіл, щавлевий альдегід, етандіаль) – жовта кристалічна речовина з запахом формальдегіду. Одержують дегідрогенізацією етиленгліколю на мідному каталізаторі.
Використовується для забезпечення нерозчинності в хімії полімерів, забезпечує властивість до незминання бавовняно-паперовим матеріалам, віскозі. Використовується при синтезі гетероциклів, особливо імідазолу.
Діацетил(диметилгліоксаль, 2,3-бутандіон) – жовто-зелена рідина, що добре розчиняється в органічних розчинниках, гірше у воді. Одержують гідратацією вінілацетилену з подальшим окисненням. Використовується як ароматизуюча речовина в харчовій промисловості, для затвердіння желатини, в фотоемульсіях та деяких клеях.
