Химическая кинетика. Химическое равновесие
Правило Ле Шателье-Брауна
Характер смещения под влиянием внешних воздействий можно прогнозировать, применяя принцип Ле Шателье: если на систему, находящуюся в равновесии оказывается воздействие извне, то равновесие в системе смещается так, чтобы ослабить внешнее воздействие.
1. Влияние концентраций.
Повышение концентрации одного из реагирующих веществ смещает равновесие в сторону расходования вещества. Понижение концентрации – в сторону образования вещества.
2. Влияние температуры.
Повышение температуры смещает равновесие в сторону реакции, идущей с поглощением теплоты (эндотермической), а понижение температуры смещает равновесие в сторону реакции, идущей с выделением теплоты (экзотермической).
3. Влияние давления.
Повышение давления смещает равновесие в сторону реакции, идущей с уменьшением объема и, наоборот, понижение давления – в сторону реакции, идущей с увеличением объема.
Пример 1. Как сместится химическое равновесие при синтезе аммиака в экзотермической реакции?
Решение. При повышении температуры в экзотермической реакции
3H2(г) + N2(г) = 2NH3(г);
ΔH0 = -92,4 кДж
реакция протекает с выделением теплоты, равновесие должно сдвигаться влево (в сторону исходных веществ).
Скорость реакции:
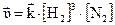 ;
;
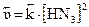 .
.
При увеличении давления в три раза концентрация веществ увеличивается также в три раза:
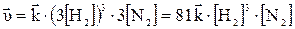 ;
;
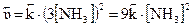 .
.
Такое изменение концентрации увеличивает скорость прямой реакции в 81 раз, а обратное в 9 раз, т.е. при увеличении давления в три раза состояние равновесия достигается быстрее в 81 : 9 = 9 раз. В левой части уравнения участвуют в реакции 3 + 1 = 4 моль веществ, а в правой части уравнения получается 2 моль, поэтому увеличение давления приводит к повышению выхода целевого продукта, что подтверждает принцип Ле Шателье.
Пример 2. При синтезе аммиака N2(г) + 3H2(г)  2NH3(г) равновесие установилось при следующих концентрациях реагирующих веществ,
2NH3(г) равновесие установилось при следующих концентрациях реагирующих веществ, 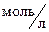 : [N2] = 4; [H2] = 2; [NH3] = 6. Рассчитайте константу равновесия этой реакции и исходные концентрации азота и водорода.
: [N2] = 4; [H2] = 2; [NH3] = 6. Рассчитайте константу равновесия этой реакции и исходные концентрации азота и водорода.
Решение. Константа равновесия реакции
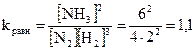 .
.
Начальная концентрация вещества складывается из равновесной концентрации этого вещества и количества вещества, израсходованного на образование равновесной концентрации продукта реакции. На основе уравнения реакции определяем количество израсходованного N2:
на образование 2 моль NH3 расходуется 1 моль N2;
на образование 6 моль NH3 расходуется x моль N2.
Отсюда 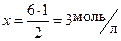 .
.
Начальная концентрация азота
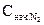 = [N2] + x = 4 + 3 = 7
= [N2] + x = 4 + 3 = 7 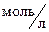 .
.
Аналогично составим пропорцию:
на образование 2 моль NH3 расходуется 3 моль H2;
на образование 6 моль NH3 расходуется y моль H2.
Отсюда 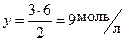
Начальная концентрация водорода
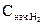 = [H2] + y = 2 + 9 = 11
= [H2] + y = 2 + 9 = 11  .
.
Ответ: начальные концентрации 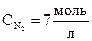 ;
; 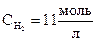
Задания
81-84. В гомогенной газовой системе установилось равновесие. Напишите выражение для константы равновесия. Дайте обоснованные ответы на вопросы: а) как и во сколько раз изменится скорость прямой реакции при увеличении давления в системе в два раза; б) как увеличение давления отразится на состоянии равновесия; в) в каком направлении сместится равновесие при увеличении температуры?
| Номер задачи | Уравнение реакции | |
H2 + I2 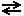 2HI 2HI | ΔH < 0 | |
N2O4 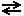 2NO2 2NO2 | ΔH > 0 | |
2A2 + B2 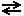 2A2B 2A2B | ΔH < 0 | |
2SO3 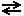 2SO2 + O2 2SO2 + O2 | ΔH > 0 |
85-88. В гетерогенной системе установилось равновесие. Напишите выражение для константы равновесия. Дайте обоснованные ответы на вопросы: а) как уменьшение давления отразится на состоянии равновесия; б) в каком направлении сместится равновесие при уменьшении температуры; в) как и во сколько раз изменится скорость прямой реакции при уменьшении давления в системе в два раза?
| Номер задачи | Уравнение реакции | |
C(графит) + СО2(г) 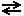 2СО2(г) 2СО2(г) | ΔH > 0 | |
MgO(к) + CO2(г) 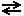 MgCO3(к) MgCO3(к) | ΔH < 0 | |
FeO(к) + H2(г) 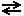 Fe(к) + H2O Fe(к) + H2O | ΔH > 0 | |
CaO(к) + H2O(г) 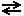 Са(ОН)2(к) Са(ОН)2(к) | ΔH < 0 |
89. Напишите выражения для скоростей прямой и обратной реакций и для константы равновесия:
2CO(г) + O2(г)  2CO2(г); ΔH0 < 0.
2CO2(г); ΔH0 < 0.
Как следует изменить в реакционном сосуде: а) температуру; б) давление, чтобы сместить равновесие в прямом направлении?
90. Напишите выражения для скоростей прямой и обратной реакций и константы равновесия:
MgCO3(к)  MgO(к) + CO2(г); ΔH0 > 0.
MgO(к) + CO2(г); ΔH0 > 0.
В каком направлении сместится равновесие: а) по мере накопления в реакторе MgO; б) при увеличении в реакторе давления; в) при увеличении температуры?
91. Напишите выражения для скоростей прямой и обратной реакций:
2NO2(г)  2NO(г) + O2(г).
2NO(г) + O2(г).
Как изменятся эти скорости: а) при увеличении концентрации NO в три раза; б) при увеличении давления в реакционном сосуде в два раза?
Как эти воздействия повлияют на состояние равновесия и величину константы равновесия? Напишите выражение для константы равновесия.
92. Константа равновесия гомогенной системы
N2 + 3H2 = 2NH3
при температуре 400°С равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 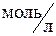 и 0,08
и 0,08 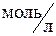 . Вычислите равновесную и начальную концентрации азота.
. Вычислите равновесную и начальную концентрации азота.
93. При некоторой температуре равновесие гомогенной системы
2NO + O2 = 2NO2
установилось при следующих концентрациях реагирующих веществ: [NO] = 0,2 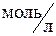 ; [О2] = 0,1
; [О2] = 0,1 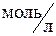 ; [NO2] = 0,1
; [NO2] = 0,1 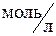 . Вычислите константу равновесия и концентрацию NO и О2.
. Вычислите константу равновесия и концентрацию NO и О2.
