Елемент Алотропні модифікації
Оксиген О кисень О2, озон О3
Сульфур S пластична, ромбічна, моноклінна
Фосфор Р червоний, білий, чорний фосфор
Карбон С алмаз, графіт, карбін, букибол
Відмінності властивостей алотропних модифікацій обумовлені різним числом атомів у молекулі або різною структурою кристалів.
Приклад 3. Чому в хімії використовують фізичну величину “кількість речовини” і в яких одиницях вона визначається? Відповідь поясніть прикладами.
Відповідь:
Моль – кількість речовини, що містить 6,02 ∙ 1023 (число Авогадро) структурних одиниць (атомів, молекул, йонів, електронів тощо).
Кількість речовини визначається в молях. Використовується вона для характеристики числа частинок, які беруть участь в реакціях.
Наприклад: 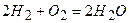
Це означає, що дві молекули водню реагують із однією молекулою кисню, при цьому отримується 2 моль води.
Приклад 4.Що означає фізична величина “молярна маса” і чим вона відрізняється від фізичних величин “молекулярна маса”, “маса атома”, “відносна молекулярна маса” і “відносна атомна маса”? Чому чисельно ці фізичні величини збігаються?
Відповідь:
Молярна маса - це маса одного моля (розмірність – г/моль), молекулярна маса – це маса одної молекули (розмірність - а. о. м.), відносна молекулярна (атомна) маса – це відношення маси молекули (атома) до 1 а. о. м. Молярна маса чисельно рівна молекулярній тому, що 1 моль – це 6,02.1023 молекул, а 1 г – це 6,02.1023 а. о. м.
Приклад 5. Що означають наступні записи:
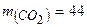 а. о. м. ;
а. о. м. ; 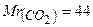 ;
; 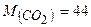 г/моль?
г/моль?
Відповідь:
Це означає, що маса однієї молекули 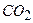 становить
становить
44 а. о. м., відносна молекулярна маса карбон (IV) оксиду - 44, а молярна маса карбон (IV) оксиду - 44 г/моль.
Приклад 6. Скільки структурних одиниць (молекул, атомів, йонів) міститься в молекулі йоду масою 50,8 г?
Дано: 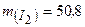 г г | Розв’язок: Молярна маса 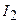 дорівнює 254 г/моль. Визначаємо кількість речовини молекулярного йоду: дорівнює 254 г/моль. Визначаємо кількість речовини молекулярного йоду: |
Знайти: 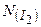 - ? - ? |
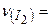
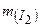 /
/ 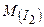
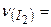 50,8 г: 254 г/моль =0,2 моль
50,8 г: 254 г/моль =0,2 моль
Визначаємо число структурних одиниць (в даному випадку – молекул) йоду, використовуючи постійну Авогадро 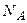 :
:
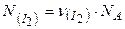 ,
,
де 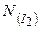 - число структурних одиниць (молекул) йоду;
- число структурних одиниць (молекул) йоду; 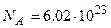 1/моль.
1/моль.
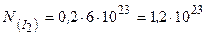
Відповідь: 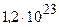 молекул.
молекул.
Приклад 7. Обчислити масу однієї молекули води в грамах.
Дано: 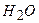 | Розв’язок: Визначаємо молярну масу води: 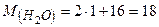 г/моль Оскільки 1 моль речовини містить г/моль Оскільки 1 моль речовини містить |
Знайти: 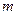 молекули молекули 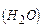 |
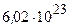 молекул (
молекул ( 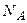 ), то, знаючи масу 1 моль води можна обчислити масу однієї молекули води:
), то, знаючи масу 1 моль води можна обчислити масу однієї молекули води:
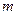 молекули
молекули 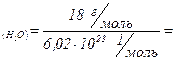
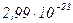 г
г
Відповідь: 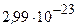 грам.
грам.
Приклад 8.Визначіть масу 1,5 ∙ 1020 молекул Са(ОН)2 в кілограмах.
| Дано: N=1,5∙1020молекул | Розв’язання: маса 1моль або 6,02∙1023 молекул рівна 74 г 1,5∙020 молекул – х г  |
Знайти: 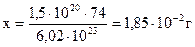 або 1,85 ∙ 10-5 кг
або 1,85 ∙ 10-5 кг
m - ?
Відповідь: 1,85 ∙ 10-5 кг
Приклад 9.Визначіть кількість речовини хлору, яка міститься в 0,56 м3 (н.у.).
| Дано: V(Cl2) = 0,56м3 = 560 л | Розв’язання: 22,4 л Cl2 за н.у. міститься 1 моль Cl2 560 л Cl2 - х моль |
Знайти: 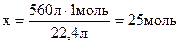
ν(Cl2) -?
Відповідь: 25 моль.
Приклад 10.Який об’єм займають за н.у. 4,8 ∙ 1026 молекул кисню ?
| Дано: N(О2) = 4,8 ∙ 1026 молекул | Розв’язання: 1 моль О2 містить: 6,02 ∙ 1023 молекул за н.у. займає 22,4 л 4,8 ∙ 1026 - х л |
Знайти:
V(Cl2) - ? 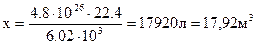 Відповідь: 17,92 м3.
Відповідь: 17,92 м3.
Приклад 11. Сформулюйте основні закони хімії. Наведіть приклади їх доказу.
Відповідь:
У XVIII - XX сторіччі були відкриті закони хімії та фізики, які стали базовою та складовою частиною атомно-молекулярного вчення.
М.В. Ломоносовим (у 1748 – 1756 рр.) та французьким хіміком А. Лавуазьє (у 1789 р.) незалежно був сформульований закон збереження маси речовин.
