Основные закономерности протекания химических реакций
Номенклатура солей безкислородных кислот.
Названия галогенидов составляются из названия галогена с суффиксом -ид и катиона (NaBr — бромид натрия.
3)Получение солей.
· Реакция нейтрализации. Растворы кислоты и основания смешивают в нужном мольном соотношении. После выпаривания воды получают кристаллическую соль
| H2SO4 | + | 2 KOH | = | K2SO4 | + | 2 H2O |
| сульфат калия |
· Реакция кислот с основными оксидами.
| H2SO4 | + | CuO | = | CuSO4 | + | H2O |
| сульфат меди |
· Реакция оснований с кислотными оксидами
| Ca(OH)2 | + | CO2 | = | CaCO3↓ | + | H2O |
| карбонат кальция |
· Реакция основных и кислотных оксидов между собой:
| CaO | + | SO3 | = | CaSO4 |
| сульфат кальция |
· Реакция кислот с солями. Этот способ подходит, например, в том случае, если образуется нерастворимая соль, выпадающая в осадок:
| H2S | + | CuCl2 | = | CuS↓ (осадок) | + | 2 HCl |
| сульфид меди |
· 6. Реакция оснований с солями. В этих реакциях образуется другое основание и другая соль.
| 3 NaOH | + | FeCl3 | = | Fe(OH)3↓ | + | 3 NaCl |
| (осадок) | хлорид натрия |
· Реакция двух различных солей. Реакцию удается провести только в том случае, если хотя бы одна из образующихся солей нерастворима и выпадает в осадок:
| AgNO3 | + | KCl | = | AgCl↓ (осадок) | + | KNO3 |
| хлорид серебра | нитрат калия |
Выпавшую в осадок соль отфильтровывают, а оставшийся раствор упаривают и получают другую соль.
· Реакция металлов с кислотами.
| Fe | + | H2SO4(разб.) | = | FeSO4 | + | H2 |
| сульфат железа II |
· . Реакция металлов с неметаллами. Эта реакция внешне напоминает горение. Металл "сгорает" в токе неметалла, образуя мельчайшие кристаллы соли, которые выглядят, как белый "дым":
| 2 K | + | Cl2 | = | 2 KCl |
| хлорид калия |
· .Реакция металлов с солями. Более активные металлы, расположенные в ряду активности левее, способны вытеснять менее активные (расположенные правее) металлы из их солей:
| Zn | + | CuSO4 | = | Cu | + | ZnSO4 | ||||
Свойства солей.
1. Некоторые соли разлагаются при прокаливании:
CaCO3 = CaO + CO2↑
2. Взаимодействуют с кислотамис образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H2 SO4 → Na2SO4 + 2HCl↑.
3. Взаимодействуют с основаниями, образуя новую соль и новое основание:
Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2.
4. Взаимодействуют друг с другомс образованием новых солей:
NaCl + AgNO3 → AgCl + NaNO3 .
5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO4 → FeSO4 + Cu↓.
Основные закономерности протекания химических реакций.
· Тепловой эффект реакции - это теплота, которая выделяется или поглощается системой при течении в ней химической реакции. В зависимости от того, происходит реакция с выделением теплоты или сопровождается поглощением теплоты, различают экзо-и эндотермические реакции. К первым, как правило, относятся все реакции соединения, а ко вторым - реакции разложения.
· Химическое равновесие - это такое состояние системы, когда скорость прямой реакции равна скорости обратной реакции.
Процессы, которые одновременно происходят в двух взаимно противоположных направлениях (прямом и обратном), называются обратимыми.
· Скорость химической реакции. Известно, что химические реакции происходят с разной скоростью. О скорости реакции делают вывод на основании изменения концентрации одного из веществ за единицу времени: 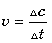 .
.
На скорость протекания реакций влияют различные факторы: природа веществ, концентрация их, температура, площадь поверхности соприкосновения реагирующих веществ, катализатор.
· Катализатор - это вещество, которое изменяет скорость химической реакции, но количественно при этом не расходуется и в состав продуктов не входит.
