Общие закономерности протекания химических реакций
При анализе возможности заданного превращения веществ или при выборе оптимального способа получения заданного продукта приходится решать две основные задачи: какой вариант энергетически более выгоден (реализуется с большей степенью превращения) и какой протекает с большей скоростью.
Вопросы, связанные с принципиальной возможностью осуществить заданное превращение веществ, независимо от того, как это будет происходить, изучаются в разделе химической теории – химической термодинамике.
Вопросы, связанные с механизмом химических реакций и их скоростью, рассматриваются в химической кинетике.
4.1 Тепловой эффект химической реакции. Понятие об энтальпии
Большинство химических реакций сопровождается выделением или поглощением тепла: первые называют экзотермическими, другие – эндотермическими. Какова природа теплового эффекта реакции? Если вспомнить, что химические превращения – это результат разрыва одних химических связей (с поглощением энергии) и образования других связей (с выделением энергии), то станет понятным, что величина и знак теплового эффекта реакции зависят от соотношения суммарной энергии связей в исходных веществах и в продуктах реакции. Если суммарная энергия связей в исходных веществах больше, чем в продуктах, то реакция будет эндотермической; если более прочные связи в продуктах – экзотермической.
Например, для реакции образования иодоводорода из простых веществ:
0,5 I2(т) + 0,5 H2(г) + = HI(г)
тепловой эффект реакции (Q) – это разность между энергией образующейся связи (ЕH–I) и суммой связей в исходных веществах: энергии испарения твердого йода (Есубл) и связей в молекулах йода (ЕI–I) и водорода (ЕH–H):
Q = ЕH–I – 0,5[ЕсублI2 + (ЕI–I + ЕH–H)] = 298,3 – 0,5(436 + 62,4 + 148,8) =
= – 25,3 кДж/моль.
Эта реакция эндотермическая, т.к. сопровождается поглощением тепла.
Раздел химии, в котором изучаются тепловые эффекты химических реакций, называется термохимией.
Тепловым эффектом химической реакции называют количество теплоты, выделившейся или поглощенной в результате превращения исходных веществ в продукты при p = const (изобарный процесс) или V = const (изохорный процесс) и равенстве температур исходных веществ и продуктов (Т исх = Т прод).
Согласно первому закону термодинамики, количество теплоты (Q), поглощенное системой (или выделившееся из нее), ведет к изменению внутренней энергии системы  (
(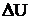 ) и совершению работы (А) против внешних сил (первое начало термодинамики):
) и совершению работы (А) против внешних сил (первое начало термодинамики):
Q = 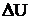 + A + A | (4.1.1) |
В химических реакциях изменение внутренней энергии системы обусловлено изменением потенциальной и кинетической энергии всех ее составных частей: молекул, атомов (или ионов), электронов, ядер атомов, их протонов и нейтронов:
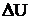 =
= 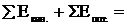 U2 – U1,
U2 – U1,
где U1 и U2 – внутренняя энергия системы до и после реакции.
Работа (А) в химических реакциях – это чаще всего работа расширения (или сжатия), т.е.
А = 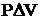 = P(V2 –V1),
= P(V2 –V1),
где V1 и V2 –объем системы до и после реакции.
Тогда для изохорного процесса (АV = 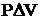 = 0)уравнение (4.1.1) преобразуется в следующее:
= 0)уравнение (4.1.1) преобразуется в следующее:
QV = 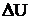 , , | (4.1.2) |
т.е. если химическая реакция не сопровождается изменением объема системы ( 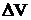 = 0), то тепловой эффект реакции равен изменению внутренней энергии системы.
= 0), то тепловой эффект реакции равен изменению внутренней энергии системы.
Если реакция протекает при постоянном давлении, то
QP = (U2 – U1) – P(V2 – V1)
После раскрытия скобок и перегруппировки получим:
QP = (U2 + PV2) – (U1 + PV1)
Функцию (U + PV) называют энтальпией (H) системы.
