Характеристика отдельных классов ферментов
1. Оксидоредуктазы. К этому классу принадлежат ферменты, катализирующие окислительно-восстановительные реакции. Как известно, в их основе лежат 3 процесса: присоединение кислорода, отщепление водорода, перенос протонов и электронов.
Это позволило выделить соответствующие подклассы оксидоредуктаз:
а) оксигеназы (гидроксилазы) – производят присоединение к субстрату атома кислорода из молекулы кислорода. Например, реакция синтеза катехоламинов:

б) дегидрогеназы катализируют реакции дегидрирования (отщепления молекулы водорода). В качестве акцепторов электронов используют коферменты НАД+, НАДФ+, ФАД, ФМН. Все ферменты этой группы обладают субстратной спецефичностью. На примере реакции цикла трикарбоновых кислот (ЦТК) получения оксалоацетата из малата:

в) оксидазы – переносят электроны и протоны на молекулярный кислород. Такие реакции протекают в процессе клеточного дыхания с участием цитохромов:

2. Трансферазы – отвечают за межмолекулярный перенос функциональных групп. В реакцию вступают 2 субстрата и получается 2 продукта реакции. В зависимости от природы переносимой группы они подразделяются на: аминотрансферазы, ацилтрансферазы, метилтрансферазы, гликозилтрансферазы, фосфотрансферазы (киназы). Пример:
3. Гидролазы – естественно, осуществляют процесс гидролиза различных сложных соединений. Подразделяют их в зависимости от расщепляемой связи: эстеразы, фосфатазы, протеазы (пептидная), гликозидазы (гликозидная), липазы (в липидах сложно-эфирная) и т.д.

4. Лиазы – группа ферментов, представляющих по механизму действия «сборную солянку». Они отщепляют от субстрата низкомолекулярные соединения (Н2О, СО2, NН3, Н2S) или присоединяют молекулу воды по двойной связи. Например:


Кроме того, это единственный класс энзимов, способных разрушить – С–С – связь. Например – альдолаза, производя подобный эффект, разделяет молекулу фруктозо – 1,6 – дифосфата в гликолизе на два триозофосфата.
5. Изомеразы – в отличие от трансфераз, осуществляющих межмолекулярную перестановку атомов, способствуют их внутримолекулярному переносу.

Если переносят группу атомов внутри молекулы, то фермент называют мутазой.

6. Лигазы (синтетазы) катализируют реакции синтеза веществ, которые не обеспечиваются только ферментами, требуется дополнительная энергия АТФ или других макроэргических соединений.

Регуляция работы фермента
Существует два способа воздействия на деятельность энзима: активация и ингибирование.
Активация энзима
Активирующее влияние на скорость ферментативной реакции оказывают разнообразные вещества органической и неорганической природы, с помощью которых, действуя на ключевые энзимы того или иного биохимического процесса, можно добиваться необходимого эффекта. Для этих целей используются следующие способы:
Аллостерическая регуляция
Аллостерическими ферментами называют белки четвертичной структуры, активность которых регулируется не только количеством молекул субстрата, но и другими веществами, называемыми эффекторами, роль которых выполняют клеточные метаболиты.
Подобные биокатализаторы играют важную роль в метаболизме, так как они чрезвычайно быстро реагируют на малейшие изменения внутреннего состояния клетки, что имеет большое значение в следующих ситуациях:
· при необходимости ускорения генерации продукта - активация начальными метаболитами позволяет осуществлять регуляцию синтеза этого соединения;
· для координации путей синтеза и распада. АТФ и АДФ - аллостерические эффекторы, действующие как антагонисты;
· для создания параллельно протекающих и взаимосвязанных метаболических путей (например, синтез пуриновых и пиримидиновых нуклеотидов, используемых в процессе полимеризации нуклеиновых кислот). Иными словами, конечные продукты одного биохимического процесса могут быть аллостерическими эффекторами другого;
· в центральных метаболических путях исходные вещества могут быть аллостерическими активаторами ферментов, их заключительных этапов:
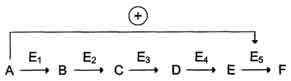
В качестве примера можно рассмотреть принципы регуляции гликолиза - специфического (начального) пути распада глюкозы. При образовании большого количества фруктозо-1,6-бисфосфата наблюдают аллостерическую активацию фермента пируваткиназы, одного из метаболитов гликолиза – работающего на конечных этапах цепи реакций.
Более редкий случай аллостерической регуляции, когда сам субстрат может выступать в качестве положительного эффектора. Такой вариант носит название гомотропного (эффектор и субстрат - одно и то же вещество). Эти энзимы имеют несколько центров связывания для субстрата, которые могут выполнять двойную функцию: каталитическую и регуляторную. Аллостерические ферменты подобного типа используются в ситуации, когда субстрат накапливается в избытке и должен быстро преобразоваться в продукт.
2.2.2. Особенности строения и функционирования аллостерических ферментов:
· аллостерические ферменты катализируют ключевые реакции различных биохимических процессов.
· обычно это олигомерные белки, состоящие из нескольких протомеров или имеющие доменное строение;
· в их молекулах выделяют аллостерический центр, пространственно удалённый от каталитического активного центра;
· эффекторы нековалентно присоединяются к аллостерическим (регуляторным) центрам фермента;
· функциональные локусы энзима могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной или групповой. Некоторые биокатализаторы обладают несколькими аллостерическими центрами, которые специфичны к активаторам.
· аллостерические ферменты обладают свойством кооперативности: взаимодействие эффектора с аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее к пространственным перестройкам активного центра и сродства фермента к субстрату, что увеличивает каталитическую активность фермента;
· регуляция аллостерических энзимов обратима: отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность биокатализатора;
