Азот( N2) и соединения азота
Сам азот — газ малореакционноспособный из-за прочной тройной связи в молекуле. Будучи относительно тяжелым, нерастворимым в воде и химически инертным, этот газ практически не уходит из атмосферы. После инертных газов у него самое большое время пребывания в атмосфере — 106 лет.
Биогеохимическая роль азота двойственна. Во-первых, он разбавляет крайне реакционноспособный кислород — иначе любая растительность активно горела бы. Во-вторых, того его количества, что вступает в химические реакции, достаточно, чтобы обеспечить всю биосферу необходимыми ей соединениями азота.
Азот вступает в реакции либо под действием нитрифицирующих бактерий (восстановление его до солей аммония), либо при очень высокой температуре (окисление до оксида азота (II)). В атмосфере такая температура достигается в грозовых разрядах, в техносфере — в карбюраторных двигателях внутреннего сгорания (системы Отто) и реактивных двигателях.
Образующийся NO, быстро окисляется кислородом воздуха, а получившийся NO2 в присутствии кислорода реагирует с водой, находящейся в виде капелек в облаках. Последнюю реакцию можно записать в виде уравнения:
4NO2 + 2Н2О + О2 = 4HNO3.
На самом деле эта реакция протекает гораздо сложнее (концентрация NO2 в воздухе даже при очень сильной грозе мала, и вероятность встречи четырех молекул — тоже очень мала). Из-за высокой реакционной способности оксидов азота их время пребывания в атмосфере составляет всего около 4 суток.
Азотная кислота вымывается из атмосферы дождями, попадает на землю, нейтрализуется основаниями, которые присутствуют в почве, и образующиеся нитраты усваиваются растениями.
Кислород (О2)
Кислород необходим почти всем живым организмам, поскольку является окислителем органических веществ. Соответствующие реакции окисления служат организмам источниками энергии. Существуют процессы, в которых организм получает энергию без использования кислорода (так называемое анаэробное дыхание), однако эти процессы менее энергетически выгодны.
Если описывать молекулу О2 методом молекулярных орбиталей, то окажется, что на разрыхляющих орбиталях молекулы кислорода находится два неспаренных электрона, то есть молекула кислорода может быть представлена как бирадикал:
О. –— О.
Поэтому она очень реакционноспособна. В частности, в газовой фазе кислород медленно присоединяется к двойным углерод-углеродным связям с последующим их разрывом:
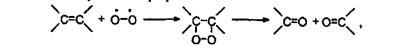
что приводит к окислению этилена и паров терпенов, находящихся в атмосфере. Кислород также присоединяется к радикалам, образующимся в результате некоторых процессов в атмосфере, образуя гидроперекиси:
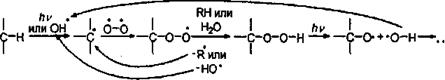
которые окисляют органические вещества в воздухе. Реакция имеет цепной характер, причем в результате может образоваться активнейший гидроксил-радикал, способствующий дальнейшему окислению органических веществ. В присутствии влаги кислород также может реагировать с минералами, содержащими двухвалентное железо (в частности, с оливином):
2Fe2SiO4 + О2 = 2Fe2O3 + 2SiO2
Долгое время в истории Земли этот процесс препятствовал накоплению кислорода в атмосфере, однако к настоящему времени минералов, содержащих доступное для кислорода двухвалентное железо, на поверхности Земли практически не осталось, и процесс перестал играть существенную роль в глобальном круговороте кислорода, хотя локально вполне может влиять на концентрацию кислорода.
Итак, живые фотосинтезирующие организмы — единственный источник и основной сток кислорода. До начала промышленной революции (середина XVIII века) атмосфера была практически стационарна по кислороду (сколько кислорода поглощалось в результате дыхания и разложения органических остатков, а также лесных пожаров, столько же выделялось в результате фотосинтеза). Относительно небольшое накопление органического вещества в болотах постоянно увеличивали и увеличивают концентрацию кислорода, но в настоящее время этот поток незначителен.
Однако последние два века человек начал извлекать органическое вещество из «могилы» в виде ископаемого топлива и сжигать его, что приводит к затратам кислорода. В результате стационарность глобальной экосистемы по кислороду сильно нарушилась (скорость образования кислорода в атмосфере —- 1,5-109 т/год, а расходования — 2,2-1010 т/год). Однако это нарушение все равно незначительно по сравнению с общей массой кислорода, то есть заметного изменения концентрации кислорода до сих пор не произошло. Более того, имеющихся запасов ископаемого топлива недостаточно, чтобы всерьез снизить его концентрацию (чего нельзя сказать о повышении концентрации СО2).
Углекислый газ (СО2)
Как и в случае кислорода, и источником, и стоком углекислого газа являются живые организмы. Углекислый газ необходим растениям для фотосинтеза сложных органических веществ, из которых они впоследствии черпают энергию и материал для постройки собственного тела. В настоящий момент углекислый газ дефицитный ресурс, в результате чего время его пребывания в атмосфере невелико — 4 года (сравните с 5000 лет для кислорода).
До начала промышленной революции атмосфера была почти стационарна по углекислому газу (не считая незначительного выведения в виде органических веществ, например, торфа). В глобальной экосистеме поддерживалось постоянство концентрации СО2 в атмосфере, в течение многих миллионов лет.
Однако с началом сжигания ископаемого топлива в атмосферу стали поступать новые порции углекислого газа. К этому добавился углекислый газ, образующийся при усилении разрушения гумуса из-за распашки почв. Одновременное разрушение почв и сведение лесов привело к тому, что увеличение интенсивности фотосинтеза не поспевает за ростом концентрации углекислого газа, и разрушение гумусового слоя привело к росту содержания углекислого газа в атмосфере.. В результате содержание углекислого газа в атмосфере примерно с 1850 года неуклонно растет:
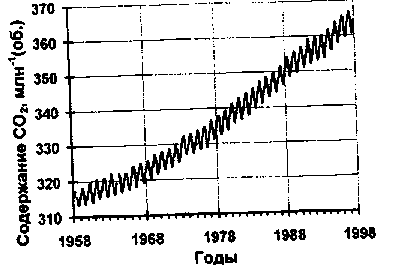
Пары воды
Из переменных компонентов больше всего в воздухе содержится паров воды (влаги). Их биогеохимическая роль очень обширна. Конденсируясь, они образуют осадки, благодаря которым жидкая вода присутствует почти во всех климатических зонах. Наличие влаги в воздухе также препятствует испарению воды из живых организмов.
Основной источник паров воды в атмосфере — испарение, а сток — конденсация. Среднее время пребывания — 10 суток. Содержание паров воды в атмосфере зависит от температуры и других факторов (например, близость водоемов). Температура ограничивает максимально возможное содержание водяного пара (при превышении этого содержания вода конденсируется).
Удельное содержание паров воды называется абсолютной влажностью. Зависимость максимально возможной абсолютной влажности воздуха от температуры приведена на рис.
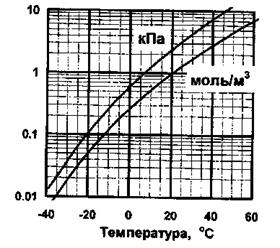
Зависимость максимально возможной абсолютной влажности воздуха от температуры. Разные кривые относятся к разным способам выражения абсолютной влажности: верхняя. кривая - парциальное давление (кПа), нижняя — молярная концентрация (моль/м3).
Реальная влажность воздуха обычно меньше максимально возможной. Отношение реальной абсолютной влажности к максимально возможной при данной температуре называется относительной влажностью воздуха. Именно эту характеристику постоянно упоминают в сводках погоды. Относительная влажность воздуха во многом определяет скорость испарения воды: чем она меньше, быстрее происходит испарение. Если относительная влажность воздуха превышает 100%, вода конденсируется.
Оксид серы (IV) (SO2)
Оксид серы (IV) попадает в атмосферу в результате деятельности вулканов (-0,6*106 моль/год), а также в результате окисления различных соединений серы, выделяемых организмами и их остатками (-2*106 моль/год). Кроме того, огромный вклад (-3*106 моль/год) в выбросы SO2 вносит деятельность человека, сжигающего серусодержащее ископаемое топливо и выбрасывающего отходы обжига сульфидных руд:
2CuS + ЗО2 = 2CuO + SO2
Стоки SO2 — вымывание атмосферными осадками и поглощение растительностью. SO2 легко растворяется в капельках воды, находящихся в облаках, образуя при этом сернистую кислоту:
H2O + SO2 = H2S03.
Поскольку мелкие капельки воды имеют очень большую поверхность, в них легко проникает кислород, который окисляет сернистую кислоту до серной:
2H2SO3 + О2 = 2H2SO4
причем по сравнению с другими химическими процессами в окружающей среде эта реакция идет довольно быстро. Хотя скорость этой реакции недостаточна для промышленного получения серной кислоты, ее вполне достаточно для того, чтобы вокруг источников SO2 постоянно выпадали кислотные дожди. Кроме того, превращение SO2 в H2SO4 ускоряется в присутствии оксидов азота.
Из-за высокой реакционной способности время пребывания SO2 в атмосфере невелико — от 3 до 7 суток.
Сероводород (Н2S)
Сероводород образуется при дегазации магмы и, в наибольших количествах, в качестве продукта жизнедеятельности организмов. Поскольку сероводород очень сильный восстановитель, он образуется только в анаэробных (бескислородных) условиях. Для большинства аэробных организмов (т.е. организмов, дышащих кислородом) токсичен.
Большие количества сероводорода выделяются при гниении, как результат восстановления серы, содержащейся в белках. Сероводород также образуется в результате деятельности сульфатредуцирующих организмов — анаэробных бактерий, которые живут, в частности, в подземных гипсовых слоях и в качестве окислителя используют сульфат-ион:
CaSО4 + «С» + 2Н2О = Са(НСО3)2 + H2S↑.
Основной сток сероводорода (равно как и других газов, содержащих серу в низких степенях окисления, например, (CH3)2S, COS) — его окисление кислородом воздуха до существенно менее токсичного S02:
2H2S + ЗО2 = 2Н2О + 2SO2.
Окисление протекает быстро, поэтому среднее время пребывания сероводорода в атмосфере не превышает одних суток.
Метан (СН4)
Источник метана в атмосфере — жизнедеятельность различных бактерий, сток — окисление кислородом воздуха. Как правило, метанообразующие бактерии обитают во влажных анаэробных условиях, например, в болотах и донных отложениях. Также они обитают в пищевом тракте травоядных животных. С 1850 года концентрация метана в атмосфере выросла в два раза и составляет в настоящий момент 1600 млрд -1
Относительно причин такого увеличения единого мнения нет. Есть гипотезы, что сказалось увеличение площадей рисовых полей (которые постоянно залиты водой и в которых поэтому существуют хорошие условия для деятельности метанобразующих бактерий), а также загрязнение болот соединениями азота и фосфора — лимитирующими ресурсами для метанобразующих бактерий. Поскольку метан — парниковый газ, увеличение его концентрации может внести свою лепту в глобальное потепление климата.
Основной сток метана — радикальное окисление кислородом, (протекает медленно). Его время пребывания в атмосфере — 3,6 года.
Инертные газы
Три инертных газа — аргон, гелий и радон — преимущественно образуются как продукты радиоактивного распада. Аргон образуется в результате распада 40К, гелий и радон — в результате распада ядер урана и тория. Все остальные инертные газы — продукты дегазации магмы. Поскольку гелий и радон — продукты радиоактивного распада, они выделяются в первую очередь над залежами пород, обогащенных ураном и торием. При этом радон (период полураспада — 3,85 суток) не успевает улететь достаточно далеко от источника, и поэтому оказывается хорошим индикатором пород, обогащенных ураном и торием. По той же причине радон отсутствует в воздушных массах, долгое время находившихся над океаном. Итак, сток радона — радиоактивный распад.
Основной сток гелия — улетучивание в космическое пространство. У остальных инертных газов стоков практически нет.
Природные источники
Поскольку в глобальном масштабе атмосферу можно рассматривать как находящуюся в состоянии равновесия, была создана модель, в которой атмосфера представлена как система, имеющая источники, резервуар (это сама атмосфера) и стоки, пребывающие в хрупком равновесии. Источники должны быть достаточно стабильными в течение длительного периода, в противном случае равновесие сдвинется.
Наиболее известный и тревожный пример такого сдвига — это увеличение источников СО2 из-за потребления огромных количеств ископаемого топлива в процессе человеческой деятельности, вызвавшем продолжительное возрастание концентрации CО2 в атмосфере. Существует множество источников микрокомпонентов в атмосфере, которые можно разделить по различным категориям, например, такие как геохимические, биологические и человеческие, или антропогенные. Некоторые из источников трудно определить по этим категориям. Является ли лесной пожар геохимическим, биологическим или антропогенным источником (особенно если лес был посажен или пожар начался вследствие человеческой деятельности)? Хотя наше разделение может оказаться несколько нечетким, источники, тем не менее, полезно разделить по категориям именно таким образом.
Геохимические источники
Возможно, самыми мощными геохимическими источниками служат переносимая ветром пыль и морские брызги, поставляющие огромные количества твердых веществ в атмосферу.
Пыль — это в основном почва аридных регионов Земли. Если эта пыль достаточно тонка, то она может распространяться на большие площади и играть важную роль в перераспределении материала. Однако часто химическое влияние пыли в атмосфере не столь очевидно из-за ее слабой химической активности. Переносимые ветром в виде частиц соли морские брызги, наоборот, более реакционноспособны в атмосфере.
Частицы соли из океанов гигроскопичны, и во влажных условиях эти крошечные кристаллы NaCl притягивают воду и образуют концентрированный капельный раствор или аэрозоль. В результате этот процесс принимает участие в образовании облаков. Капельки могут быть также местом протекания важных химических реакций в атмосфере. Если в капельках растворяются сильные кислоты, например азотная (HNO3) или серная (Н2S04), то может образоваться соляная кислота (НС1). Считается, что этот процесс является важным источником НСl в атмосфере:
H2SO4+NaCl-> НС1 + NаНSО4
Метеоры также могут приносить частицы в атмосферу. Это очень небольшой источник по сравнению с переносимой ветром пылью или лесными пожарами, но метеоры играют большую роль в верхних частях атмосферы, где плотность газов невысока. Здесь даже небольшой вклад может быть очень значителен и металлы, приносимые с метеорами, вступают в ряд химических реакций.
Наземные вулканы представляют наибольший источник пыли, которая в результате особенно сильных извержений может выноситься и в стратосферу. Издавна известно, что вулканические частицы могут влиять на глобальную температуру, задерживая солнечный свет. Они также могут нарушать химические процессы на больших высотах. Вулканы служат также огромным источником не только пыли, но и таких газов, как диоксид серы (SO2), CO2, HC1 и фтористый водород (HF). Эти газы вступают в реакции в стратосфере, давая начало другим частицам, из которых важнейшей является H2SO4, вырабатываемая косвенным путем из вулканических источников.
Необходимо понимать, что вулканы — это весьма непостоянный источник частиц, как во времени, так и в пространстве. Сильные вулканические извержения редки. Бывает, что проходят годы без больших извержений и затем вдруг единовременно высвобождается больше вещества, чем за многие предыдущие десятилетия. Извержения происходят в очень специфических районах, где расположены действующие вулканы. Кроме крупных извержений, в результате которых большое количество вещества попадает в верхние слои стратосферы, следует учитывать и небольшие фумарольные выбросы из вулканических трещин и расселин, из которых газы медленно выходят в нижние слои атмосферы в течение очень длительного времени. Баланс между этими двумя типами вулканических источников точно неизвестен, хотя для SO2 он составляет, вероятно, 50:50.
Радиоактивные элементы пород, в основном калий и такие тяжелые элементы, как радий, уран и торий, могут высвобождать газы. Аргон является результатом распада калия, а радон, радиоактивный газ с периодом полураспада 3,8 дней — распада радия. Серии уран-ториевых распадов приводят к образованию α-частиц, являющихся ядрами гелия. Когда эти ядра захватывают электроны, гелий поступает в атмосферу. Гелий не накапливается в атмосфере, поскольку он достаточно легкий газ и выносится в космос. Таким образом, концентрация гелия в состоянии устойчивости определяется балансом между его радиоактивным излучением из коры и потерей из верхних слоев атмосферы.
Биологические источники
В отличие от геологических источников биологические не являются крупным прямым источником поступления частиц в атмосферу, за исключением лесных пожаров. Лесные пожары служат значительным источником углерода, в виде частиц сажи.
Кроме того, живой лес играет большую роль в обмене газон с атмосферой. Основные газы атмосферы О2 и СО2 вовлечены в процессы дыхания и фотосинтеза. Однако лесами выделяются также огромные количества следовых органических соединений. Такие терпены, как пинен и лимонен, придают лесам их чудесный аромат. Леса являются также источниками органических кислот, альдегидов и других органических соединений.
Несмотря на очевидность того, что леса представляют мощный источник газов, особенно важную роль в генерации атмосферных следовых газов играют микроорганизмы. Метан — газ, который накапливается вследствие протекания реакций в анаэробных системах. Влажные почвы и болота, рисовые поля служат средой для микроорганизмов так же, как и пищеварительный тракт жвачных животных, например крупного рогатого скота.
Почвы Земли богаты соединениями азота, дающими начало всему спектру активных химических процессов с участием азота, в результате которых накапливаются многие азотсодержащие следовые газы. Можно взять мочевину (NH2CONH2), присутствующую в моче животных, как типичное азотное соединение почв, накапливаемое биологическим путем. В результате гидролиза NH2CONH2 разлагается до аммиака и СО2:
НН2СОNН2 + Н20 -> 2NH3+ СО2.
Если почва, где произошел этот гидролиз, имела щелочную реакцию, то выделяется газообразный NH3, тогда как в условиях кислой среды он прореагирует с образованием иона аммония NH4+
NH3 + Н+ -> NH4+
Растения могут поглощать почвенные NH3 или NH4+ прямым путем, а некоторые микроорганизмы, окисляют NH4+, используя его в качестве источника энергии в процессе дыхания так же, как другие клетки используют восстановленные соединения углерода. Одной из возможных является реакция
2NH3 + 202 -» N20 + ЗН20
Это биологический источник закиси азота (N2O), важного и достаточно устойчивого газа тропосферы. В природе протекают многие другие реакции с участием соединений азота, в процессе которых образуются газы NH3, N2, N20 и оксид азота (NO).
Деятельность микроорганизмов в океанах также является мощным источником следовых газов. Морская вода обогащена растворенными сульфатами и хлоридами (и в меньшей степени солями других галогенов: фтора (F), брома (Вг), йода (I)). Морские микроорганизмы используют эти элементы в метаболизме, в результате чего образуют серу (S) и галогенсодержащие следовые газы. Однако содержание азота в поверхностных морских водах настолько низкое, что в действительности океаны являются азотной пустыней. Это означает, что морская вода не служит достаточно большим источником азотсодержащих микрокомпонентных газов.
 Органические сульфиды, продуцируемые морскими микроорганизмами, вносят особо существенный вклад в накопление серы в атмосфере. Наиболее типичным соединением является диметилсульфид - ДМС - (CH3)2S. Это летучее соединение образуется морским фитопланктоном, в верхних слоях океана в процессе гидролиза бетадиметилсульфопропионата (CH3)2S+CH2CH2COO- до ДМС и акриловой кислоты (CH2=CHCOOH):
Органические сульфиды, продуцируемые морскими микроорганизмами, вносят особо существенный вклад в накопление серы в атмосфере. Наиболее типичным соединением является диметилсульфид - ДМС - (CH3)2S. Это летучее соединение образуется морским фитопланктоном, в верхних слоях океана в процессе гидролиза бетадиметилсульфопропионата (CH3)2S+CH2CH2COO- до ДМС и акриловой кислоты (CH2=CHCOOH):
(CH3)2S+CH2CH2COO- -» (CH3)2S + СН2=СНСООН
Другим важным соединением серы, выделяемым океанами, является карбонилсульфид (COS). Он может образоваться в результате реакции между дисульфидом углерода (CS2) и водой:
CS2 + H2O -» COS + H2S
и, несмотря на то что поток его в атмосферу меньше, чем ДМС, из его устойчивости следует, что он будет накапливаться в больших концентрациях. Эти серосодержащие газы малорастворимы в воде, что способствует их выходу из океанов в атмосферу.
Хорошо известно существование органических галогенпроизводных в атмосфере. Несмотря на очевидную зависимость от антропогенного источника - жидкостями, применяемыми для химчистки, в огнетушителях и распыляемыми аэрозолями, существует также множество биологических источников. Метилхлорид (СНзС1), наиболее распространенный в атмосфере галогенуглеводород, происходит в первую очередь из плохо изученных морских источников; некоторый вклад вносят также микробиологические процессы на суше и сгорающая биомасса. Содержащие бром и йод органические соединения также выделяются океанами, а распределение морского йода по поверхности суши служит значительным источником этого необходимого следового элемента для млекопитающих. Можно сказать, что базедова болезнь, возникающая в результате дефицита йода, особенно распространена в областях, удаленных от океана.
