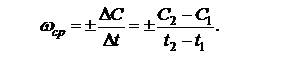Скорость химической реакции
Семинар 3. ХИМИЧЕСКАЯ КИНЕТИКА
Предмет и методы химической кинетики. Основные понятия. Реакции простые и сложные, гомогенные и гетерогенные. Скорость гомогенных химических реакций и методы ее измерения. Зависимость скорости реакции от различных факторов.
Влияние концентрации. Закон действующих масс. Молекулярность и порядок реакции. Уравнение кинетики реакций нулевого, первого и второго порядков. Период полупревращения. Методы определения порядка реакции.
Влияние температуры. Правило Вант-Гоффа. Температурный коэффициент скорости реакции. Уравнение Аррениуса. Энергия активации, ее определение на основе экспериментальных данных. Ускоренные методы определения срока годности лекарственных препаратов..
Влияние катализатора. Общие закономерности катализа. Типы катализа: гомогенный, гетерогенный, ферментативный. Механизм действия катализатора. Гомогенный катализ, общие кинетические закономерности. Гетерогенный катализ, основные его стадии. Ферментативный катализ и его особенности. Константа Михаэлиса.
Основные понятия о кинетике сложных реакций: обратимые, параллельные, последовательные, сопряженные. Превращение лекарственного вещества в организме как совокупность последовательных процессов. Константа всасывания и константа элиминации. Фотохимические реакции, закон эквивалентности Эйнштейна. Квантовый выход реакции. Цепные реакции (неразветвленные и разветвленные), их механизм.
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Направление химической реакции можно определить с помощью химической термодинамики. Однако химическая термодинамика не позволяет установить продолжительность химической реакции или предсказать, осуществима ли она вообще. Есть немало примеров самопроизвольного протекания химических реакций с точки зрения химической термодинамики, которые на практике не реализуемы без внешнего воздействия. Например, смесь газообразных водорода и кислорода термодинамически неустойчива и должна самопроизвольно прореагировать с образованием воды. Тем не менее эту смесь можно наблюдать очень долго, при этом, мы не обнаружим образование воды. Определить реальность протекания химических реакций во времени позволяет химическая кинетика.
Химические реакции протекают с различной скоростью. Учение о скорости, механизме химических реакций и их зависимости от разных факторов (концентрации, температуры, катализатора и т. д.) называется химической кинетикой.
Скорость химической реакции в газах и растворах определяется изменением концентрации любого из реагентов, принимающих участие в процессе, в единицу времени в единице объема:
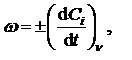 | (5.1) |
где ω − скорость реакции; d − бесконечно малое изменение концентрации i-го компонента за бесконечно малый промежуток времени dt при постоянном объеме. Размерность скорости реакции: концентрация -1 время-1. Знак минус справа ставится при определении скорости реакции по одному из исходных веществ.
Скорость реакции в данный момент времени (истинная скорость) можно рассчитать графически по кинетической кривой изменения концентрации, или какого-то физического свойства вещества, пропорционального концентрации, от времени. Для этого проводят касательную к кинетической кривой, и скорость реакции (согласно (5.1)) будет равна тангенсу угла наклона касательной к кривой в данной точке: ω = tg α = AB/BC (рис. 5.1). Чтобы правильнопровести касательную, можно использовать следующий приём. Небольшое зеркало ставят перпендикулярно плоскости рисунка так, чтобы отраженная в зеркале часть кривой была плавным продолжением кривой на рисунке. Затем вдоль зеркала проводят прямую. Перпендикуляр к этой прямой, проведенный через выбранную точку, и будет касательной.
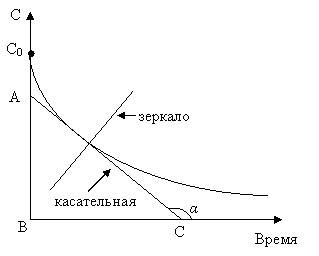
Рис. 5.1. Определение скорости реакции по кинетической кривой
Средняя скорость реакции характеризует изменение концентрации за определенный конечный промежуток времени:
| (5.2) |