Строение и биологическая роль аминокислот, пептидов, белков
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
ЧИТИНСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
КАФЕДРА ХИМИИ И БИОЛОГИЧЕСКОЙ ХИМИИ
БЕЛКИ. ФЕРМЕНТЫ
УЧЕБНОЕ ПОСОБИЕ
ЧИТА - 2011
УДК – 612.015.348 : 612.015.1
ББК –28.072
О.К. Плотникова, Л.П. Никитина
Белки. Ферменты: Учебное пособие. – Чита, 2011. – 80 с.
Учебное пособие составлено в соответствии с рабочей программой лечебного и педиатрического факультетов медицинских вузов. В нём подробно изложены материалы, касающиеся строения, свойств и биологической значимости белков и ферментов. Приведены примеры их влияния на биохимические процессы в жизнедеятельности организма и использования в медицине. Включены также ситуационные задачи и тестовые задания для оценки уровня знаний.
Учебное издание предназначено для студентов лечебного и педиатрического факультетов медицинских вузов.
Рецензенты:
Старший научный сотрудник лаборатории экспериментальной
и клинической биохимии и иммунологии НИИ медэкологии при
ГБОУ ВПО Читинской государственной Медицинской академии
к.б.н. М.В. Максименя
Учебное пособие утверждено цикловой методической комиссией медико-биологических дисциплин ЧГМА (протокол № 73 от 27.10.2011) и центральным методическим координационным Советом ЧГМА (протокол № …от ...12.2011)
Плотникова О.К., Никитина Л.П., 2011
ГБОУ ВПО ЧГМА, 2011
Содержание
Список сокращений ………...…………………………………………………….5
Введение …………………...……………………………………………………...6
І. Тема: Белки …………………………………...….……………………………..7
1. Строение и биологическая роль аминокислот, пептидов, белков ………….7
2. Свойства протеинов …………………………………………..……………...18
2.1. Физико-химические свойства биополимеров ….…………………....21
2.2. Особенности биологических свойств белков …………..…………...22
3. Методы очистки и выделения белков ……………………………….……...22
4. Классификация белков ………………………………………………….…...24
4.1. Простые белки …………………………………………………….......25
4.2. Сложные белки ……………………………………………………..…31
5. Биологическая роль протеинов ……………………………………………...41
6. Вопросы для самоконтроля ………………………………………………….39
7. Тестовые задания для оценки уровня знаний ..……………………………..40
8. Ситуационные задачи ……………………………………………………......43
ІІ. Тема: Ферменты ………………………………………………………….…..49
1. Особенности строения ферментов ………...………….……………….……50
1.1. Энзим – сложный белок ………………………………………...…….51
1.2. Функциональные центры фермента …………….……………..…….56
2. Энзимы как биокатализаторы ...………………………………………..……57
2.1. Теории, объясняющие механизмы работы ферментов……………...57
2.2. Специфичность действия энзимов ...………………………………....58
2.3. Кинетика ферментативных реакций ………………………………....59
3. Классификация, номенклатура ферментов ………………...………………62
3.1. Классификация энзимов ………………………………....……………62
3.2. Характеристика отдельных классов ферментов …………..………...62
4. Положительная и отрицательная регуляции работы ферментов ………….65
4.1. Механизм аллостерической регуляции ……………………………...70
4.2. Последствия белок - белкового взаимодействия ……………………73
4.3. Регуляция путём ковалентной модификации ...…………………..…74
4.4. Частичный протеолиз, как способ активации зимогена ….………...74
5. Использование ферментов в медицине …………………………….……….73
5.1. Энзимопатии …………………………………………………………..74
5.2. Энзимодиагностика …………………………………………………...74
5.5. Энзимотерапия ………………………………………………………...75
6. Вопросы для самоконтроля ………………………………………………….77
7. Тестовые задания для оценки уровня знаний ..……………………………..77
8. Ситуационные задачи ………………………………………………………..79
9. Приложение №1 Строение протеиногенных аминокислот ......………........83
10. Список литературы …………………………………………………….........81
СПИСОК СОКРАЩЕНИЙ
АДФ– аденозиндифосфорная кислота
а/к – аминокислоты
АТФ- аденозинтрифосфорная кислота
ГАГ– гликозаминогликаны
ГТГ – гонадотропные гормоны
ДГ – дегидрогеназа
ЖКТ – желудочно – кишечный тракт
ИЭТ – изоэлектрическая точка
к.ц. – кислотный центр
ЛДГ – лактатдегидрогеназа
ЛП– липопротеин
ЛПВП – липопротеин высокой плотности
ЛПНП – липопротеин низкой плотности
ЛПОВП – липопротеин очень высокой плотности
ЛПОНП – липопротеин очень низкой плотности
ЛППП – липопротеин промежуточной плотности
НАД+ – никотинамидадениединуклеотид (окисленная форма)
н/ф– нуклеофил
НЭХС– неэтерифицированный(свободный) холестерин
о.ц. – основный центр
ПВК – пировиноградная кислота
п/п – полипептид
ТАГ – триацилглицеролы
ТТГ – тиреотропный гормон
УФО – ультрафиолетовое облучение
ФАД– флавинадениндинуклеотид
ФЛ– фосфолипид
ФМН – флавинмононуклеотид
ХМ – хиломикроны
ХС – холестерол
ЦТК – цикл трикарбоновых кислот
э/ф – электрофил
ЭХС – этерифицированный холестерол
Hb– гемоглобин
ВВЕДЕНИЕ
Биохимия –это наука, которая изучает механизмы развития, функционирования организмов на молекулярном уровне, структуру химических веществ и процессы, происходящие с ними, обеспечивая жизнь существ, населяющих Землю. В живых клетках происходит синтез множества органических молекул, среди которых особое значение имеют биополимеры – белки, нуклеиновые кислоты, полисахариды.
Важная роль в жизнедеятельности организмов принадлежит протеинам. Из поколения в поколение передаётся генетическая информация об их специфических структуре и функциях, что обеспечивает видовую и индивидуальную специфичность организма в целом и определяет особенности его строения и функционирования. Любые перемены в последовательности аминокислот могут привести к изменению конформации с последующим повреждением соответствующих механизмов и развитием заболеваний.
І. ТЕМА: БЕЛКИ
I. Цели занятия:
1. изучить строение и свойства протеиногенных аминокислот и химические основы структурной организации пептидов и белковых молекул для дальнейшего понимания их биологической роли;
2. основываясь на строении белковых молекул, обосновать их свойства, познакомиться с факторами стабильности белковых растворов, приемами очистки и осаждения протеинов, использованием в клинике реакций их необратимого осаждения;
3. сформировать представления о структуре простых и сложных белков, познакомиться с классификацией и биологической ролью их важнейших классов.
II. Учебные задачи
Изучить:
1. классификацию аминокислот, пептидов, белков;
2. основные свойства и функции протеинов;
3. методы очистки и выделения белков;
4. способы образования белковых молекул.
Уметь:
1. писать формулы аминокислот;
2. строить пептиды;
3. находить заряд и изоэлектрическую точку аминокислот и пептидов;
4. правильно определять свойства протеинов в зависимости от строения молекул;
5. распознавать и выделять полипептиды;
6. применять знания о белках в клинике.
Ознакомиться:
1. с принципами образования белковых структур;
2. с разнообразными классами протеинов;
3. с методами использования их в медицине.

СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ РОЛЬ АМИНОКИСЛОТ, ПЕПТИДОВ, БЕЛКОВ
Гетерофункциональные соединения, молекулы которых содержат одновременно амино- и карбоксильную группы, называются аминокислотами(а/к). Общее число, встречающихся в природе аминокислот, достигает 100. При этом в организме человека их найдено около 70, из которых > 20 входят в состав белков. Ф.Крик назвал их “магической двадцаткой”. Только они шифруются генетическим кодом. Эти кислоты относятся к a-аминокислотам (a- потому что у a-С атома по рациональной номенклатуре) и называются протеиногенными (Приложение 1):
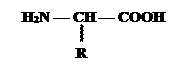
Существуют различные классификации, входящих в состав белков, в зависимости от признака, положенного в основу их деления на группы. Так по химической природе боковой цепи выделяют алифатические (ациклические), ароматические, гетероциклические. По количеству функциональных групп: аминомонокарбоновые, диаминомонокарбоновые, аминодикарбоновые. В зависимости от наличия иных функциональных групп в радикале: включающие гидрокси- (оксиаминокислоты), амидо-, серо- и иминосодержащие. В зависимости от вариантов происхождения аминокислоты бывают незаменимые, которые не способны синтезироваться в организме, отсюда должны поступать с пищей (вал, лей, иле, лиз, тре, мет, фен, три) и заменимые – которые могут и содержаться в продуктах питания, и образовываться при необходимости в клетках. При некоторых, чаще всего наследственых заболеваниях, перечень незаменимых кислот расширяется. Так при фенилкетонурии нарушены реакции, с помощью которых создаётся тирозин (отсюда – условнозаменимые а/к).
По отношению к воде (растворимости их радикалов) подразделяются на:
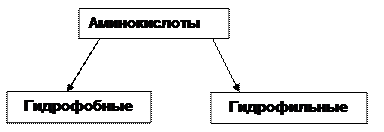
По степени ионизации их можно разделить на кислые, основные и нейтральные. В организме все полярные радикалы гидрофильных кислот находятся в диссоциированном состоянии. Их молекулы имеют заряд. Он обусловлен соотношением кислотных и основных центров в соединении. Если преобладают кислотные (асп, глу) – заряд отрицательный, если основные (арг, лиз, гис) – положительный. Для формирования заряда важную роль играет рН среды, в которой соединение растворено. В нейтральной среде аминокислоты, содержащие дополнительную карбоксильную группу, имеют суммарный отрицательный заряд и называются кислыми:
