Номенклатура комплексних сполук 3 страница
Налити у пробірку 2–3 мл розчину алюміній сульфату і додати такий самий об’єм розчину натрій карбонату. Спостерігати випадіння аморфного осаду та виділення бульбашок газу. Визначити рН розчину за допомогою універсального індикатору. Осад промити 2–3 рази гарячою водою і перевірити на розчинність у хлоридній кислоті (чи виділяється газ ?) та у надлишку лугу. Записати рівняння реакцій.
Дослід 4.2.3. Визначення реакції середовища у розчинах солей
за допомогою універсального індикатору
Визначити середовище у розчинах солей (вказує викладач), дослідивши їх дію на універсальний індикатор шляхом нанесення краплі розчину на індикаторний папірець. Результати випробування занести в таблицю:
| Формула солі | Колір рН-індикаторного папірця | рН |
| Na2CO3 | ||
| ZnCl2 | ||
| KCl | ||
| Al2(SO4)3 |
Записати рівняння реакцій гідролізу вказаних солей.
Дослід 4.2.4. Визначення реакції середовища за допомогою індикаторів
Взяти чотири пробірки, в кожну налити по 5 крапель досліджуваного розчину (NaNO3, СН3СООNH4, СН3СООNa, K2CO3) і по одній краплі розчину фенолфталеїну. Якщо забарвлення стане малиновим, тоді рН = 8,2-10. Результат записати у таблицю. Знову взяти чотири пробірки із розчинами, в кожну додати по одній краплі метилового оранжевого. При жовтому кольорі розчину рН > 4,4; при помаранчевому – 3,2-4,4; при рожевому – < 3,2. Аналогічно провести досліди з комбінованим індикатором. При бузковому кольорі індикатора рН < 3,1, при майже безбарвному – рН 3,1-5,1, при зеленому рН > 5,1. Дані записати у таблицю.
| Розчин | Колір рН-індикатор-ного паперу | Колір розчину в присутності рідкого індикатора | ||
| фенолфталеїну | метилоранжу | комбінованованого | ||
4.3. Контрольні запитання
| 1. | Записати іонні та молекулярні реакції гідролізу солей, охарактеризувати середовище в розчині цих солей: CaCl2 ; Na2SO3 ; CuSO4 ; Al2S3. |
| 2. | Що називається індикатором ? Що називається інтервалом переходу індикатору ? |
| 2. | Вказати яку реакцію на лакмус мають розчини солей: NH4CN; KCl; K2S; Na2SiO3; NH4NO3. |
| 3. | Розрахувати рН розчину, якщо [H+] = 0,0001 моль/л. |
| 4. | Яка концентрація гідроксил-іонів у розчині з рН 5 ? |
| 5. | Як впливають на ступінь гідролізу температура, розведення, реакція середовища і природа солі ? |
| 6. | У скільки разів концентрація гідроксил-іонів у розчині з рН = 12 більше концентрації іонів Гідрогену ? Відповідь підтвердити розрахун-ками. |
ЛАБОРАТОРНА РОБОТА № 5
ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
Теоретична частина
Ступінь окиснення – умовний заряд атома, розрахований із припущення що молекула складається лише із іонів.
Для знаходження ступенів окиснення елементів у складних сполуках користуються наступними правилами:
1. Ступінь окиснення атомів в простих речовинах дорівнює нулю ( 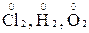 );
);
2. Атоми Оксигену в сполуках мають ступінь окиснення -2; виняток становлять пероксиди, де ступінь окиснення Оксигену складає -1 (наприклад, 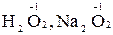 ) і оксиген фторид
) і оксиген фторид 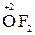 , де ступінь окиснення становить +2.
, де ступінь окиснення становить +2.
3. У Гідрогену в сполуках ступінь окиснення +1; виняток становлять гідриди металів, де ступінь окиснення Гідрогену складає -1 (наприклад, 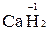 ).
).
4. Оскільки молекула у цілому електронейтральна, алгебраїчна сума ступенів окиснення усіх атомів, що входять у сполуку, дорівнює нулю.
У будь-якій окисно-відновній реакції беруть участь одночасно окисник і відновник. До відновників належать речовини, атоми (або іони) яких від-дають електрони, а до окиcників – речовини, що приєднують ці електрони. Процес віддавання електронів називається окисненням, а процес при- дбання електронів – відновленням.
Хімічні реакції, що протікають зі зміною ступенів окиснення елементів, що входять до складу речовин, називаються окисно-відновними.
Існує три типи окисно-відновних реакцій:
1. Реакції міжатомного або міжмолекулярного окиснення-віднов-лення. До них належать такі реакції, в яких обмін електронами відбува-ється між різними атомами, молекулами або іонами. Наприклад:
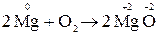 .
.
2. Реакції диспропорціонування (самоокиснення-самовідновлення).
У таких реакціях прості і складні речовини можуть виявити як окисні, так і відновні властивості. Це можливо внаслідок того, що атоми з проміжним ступенем окиснення віддають і приймають електрони. Наприклад, в реакції:
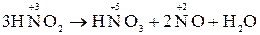
N3+ відіграє роль як окисника, так і відновника.
3. Реакції внутрішньомолекулярного окиснення-відновлення. До них належать реакції, в яких і окисник і відновник входять до складу тієї ж ре-човини (молекули):
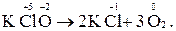
До найважливіших відновників відносяться лужні та лужноземельні метали; кислоти, що не містять Оксигену (HCl, HBr, HJ, H2S, H2Se, H2Te) та їх солі, гідриди лужних і лужноземельних металів (NaH, CaH2), а також сполуки неметалів з Гідрогеном (NH3, N2H4, PH3, P2H4 тощо). Роль відновників відіграють також позитивно заряджені іони металів, що мають нижчі ступені окиснення (Cu+, Fe2+, Mn2+, Cr3+ та інші). До сильних окисників відносять галогени, озон, кисень, сірку, сполуки, що містять позитивно заряджений іон Гідрогену H+ у складі води чи кислот. Виконують роль окисників також метали з найвищим ступенем окиснення у вигляді оксидів, кислот та їх солей. Типовими представниками цих сполук є Mn2O7, KMnO4, HMnO4, CrO3, K2Cr2O7, K2CrO4, NaBiO3, Na2FeO4, V2O5, NaVO3 тощо. Оксиген у атомарному стані і у складі простої речовини – кисню, а також у вигляді озону О3 є дуже сильними окисниками. Роль окисників виконують також молекули галогенів F2, Cl2, Br2, J2 та вищі оксигеновмісні кислоти неметалів (HClO, HClO3, HClO4).
Експериментальна частина
Дослід 5.2.1.Окисні властивості калій дихромату
У дві пробірки взяти по 2-3 краплі розчину калій дихромату, додати по 3-4 краплі розчину сульфатної кислоти. У першу пробірку додати щіпку натрій сульфіту, у другу – декілька кристалів натрій нітриту. Відмітити зміну кольору розчинів. Написати рівняння реакцій, скласти схему електронного балансу до кожної з них, підібрати коефіцієнти.
Дослід 5.2.2. Вплив середовища на окисно-відновні процеси
У три пробірки помістити по 3-4 краплі розчину KMnO4. У першу додати 1 краплю розчину H2SO4, у другу 3-4 краплі дистильованої води, в третю – 2-3 краплі розчину NaOH. Чи змінився при цьому колір розчину KMnO4 ?
Далі у кожну пробірку додати щіпку порошку натрій сульфіту. Що відбувається ? Написати рівняння реакцій, скласти схему електронного балансу до кожної з них, підібрати коефіцієнти.
Дослід 5.2.3. Окисні властивості галогенів
Налити у пробірку 4-5 крапель розчину натрій сульфіду і додати 3-4 краплі йодної води (водний розчин йоду). Чому знебарвився розчин йоду та випав осад сірки ? Написати рівняння реакцій, скласти схему електронного балансу, підібрати коефіцієнти.
Дослід 5.2.4. Окиснення іонів J– іонами Fe3+
У пробірку налити 5–7 крапель розчину Fe2(SO4)3 або FeCl3 , додати 3-4 краплі безбарвного розчину KI. Розвести суміш 15-20 краплями дистильованої води і добавити 1-2 краплі розчину крохмалю. Поява синього забарвлення свідчить про утворення в розчині вільного йоду. Як це пояснити? Написати рівняння реакцій, скласти схему електронного балансу до кожної з них, підібрати коефіцієнти.
Дослід 5.2.5. Окиснення іонів Fe2+ перманганат-іонами
В пробірку налити 2-3 каплі розчину калій перманганату і 2-3 каплі 2 н розчину сульфатної кислоти. По каплях додати свіжоприготований розчин ферум (ІІ) сульфату до повного знебарвлення розчину. Скласти рівняння окисно-відновної реакції.
5.3. Контрольні запитання
| 1. | Визначити ступінь окиснення Фосфору в речовинах: H4P2O7; Ca(H2PO4)2; PH3; Mg3P2: PCl5 |
| 2. | Визначити ступінь окиснення Купруму в речовинах: Cu2O; Cu(NO3)2; (CuOH)2CO3; CuCl; Cu(OH)2. |
| 3. | Методом електронного балансу проставити коефіцієнти в окисно-відновній реакції, вказати процеси окиснення та відновлення: KMnO4 + Na2SO3 + H2O → MnO2 + Na2SО4 + КОН |
| 4. | Вказати кількість електронів, відданих чи приєднаних атомами згідно схем: KMnO4 → MnSO4; FeBr3 → Fe; H2SO3 → H2SO4; HNO3 → NO2 |
| 5. | Який процес (окиснення чи відновлення) протікає під час переходу: HNO2 → HNO3; NaBrO3 → Br2; KMnO4 → MnO2; KJ → J2; HNO3 → NH4+ |
| 6. | Методом електронного балансу проставте коефіцієнти в окисно-відновній реакції, вкажіть процеси окиснення та відновлення: HJ + KMnO4 + H2SO4 → J2 + MnSO4 + К2SО4 + H2O |
| 7. | Визначити ступінь окиснення Хрому в сполуках: CrO3; CrO; Cr2(SO4)3; Cr(OH)2; K2Cr2O7. |
| 8. | Визначити ступені окиснення кожного елемента у наступних сполуках: CaC2; KA1(SO4)2; SiC; SnCl4; КС1О3; As2S3. |
| 9. | На основі електронного балансу розставити коефіцієнти в окисно-відновній реакції, вказати окисник та відновник: SO2 + К2Сr2О7 + Н2SO4 ® К2SO4 + Сr2(SO4)3 + H2O. |
ЛАБОРАТОРНА РОБОТА № 6
КОМПЛЕКСНІ СПОЛУКИ
Теоретична частина
Номенклатура комплексних сполук
Першу раціональну номенклатуру комплексних сполук розробив Вернер. Ця теорія з незначними змінами використовується і в наш час.
Спочатку називають аніон (в називному відмінку), а потім катіон (в ровому відмінку).
Якщо в сполуку входить комплексний катіон, тоді спочатку називають ліганди – нейтральні молекули, які входять до комплексу. При цьому амоніак називають амін (його називають першим), воду – акво (називають після амоніаку); якщо лігандів декілька, тоді спочатку називають їх кількість на грецькій мові: 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса. Наступними називають ліганди-іони, які входять до комплексу (частіше – залишки кислот), додаючи закінчення «о», наприклад, ціано- (CN-), нітро- (NО2-), хлоро- (С1-), гидроксо- (ОН-), гідридо- (Н-), оксо- (О2-), тіо- (S2-), родано- або тіоціанато- (SCN-), оксалато- (С2О42-) і т. і. Далі називають комплексоутворювач (назва елемента українською мовою). В дужках показують його ступінь окиснення. Наприклад:
[Ag(NH3)2]Cl – хлорид диамінсрібла (I)
[Сu (NH3)4]SО4 – сульфат тетраамінміді (II)
[PtCl(NH3)5]Cl3 – хлорид пентаамінхлорплатини (IV)
Якщо в сполуку входить комплексний аніон, тоді також спочатку називають ліганди – нейтральні молекули, а потім ліганди-іони з використанням в назві грецьких чисельників (якщо необхідно), як і у випадку комплексного катіона. Після цього називають комплексоутворювач, використовуючи латинську назву елемента з додаванням -ат, а перед назвою елемента в дужках вказується ступінь його окиснення. Далі називають катіон зовнішньої сфери в родовому відмінку. Наприклад:
К[Ag(CN)2] – диціаноаргентат (I) калію
К3[Fe(CN)6] – гексаціаноферат (III) калію
Назву нейтральних комплексів (комплексів неелектролітів) складають із назв лігандів (в указаній вище послідовності) і звичайних назв центральних атомів на українській мові в називному відмінку. При цьому ступінь окиснення не вказується. Наприклад:
[PtCl4(NH3)2] – диамінтетрахлороплатина
[Со (NО2)3(NH3)3] – триамінтринітрокобальт
Дисоціація комплексних сполук
Більшість координаційних сполук у розчинах виявляють властивості сильних електролітів внаслідок дисоціації їх на комплексні іони та іони, що складають зовнішню сферу:
[Ag(NH3)2]Cl 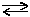 [Ag(NH3)2]+ + Cl-;
[Ag(NH3)2]+ + Cl-;
Na2[Zn(OH)4] 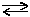 2Na+ + [Zn(OH)4]2-.
2Na+ + [Zn(OH)4]2-.
Така дисоціація комплексних сполук є первинною. Вона протікає повністю.
Однак комплексні іони здатні також частково дисоціювати на складові іони та молекули. Цей процес має назву вторинноїдисоціації і проходить ступінчасто:
[Ag(NH3)2]+ 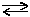 Ag ++ 2NH3;
Ag ++ 2NH3;
[Zn(OH)4]2- 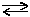 Zn2+ + 4OH-.
Zn2+ + 4OH-.
Ця дисоціація звичайно протікає незначною мірою.
Дисоціація комплексного іона характеризують за допомогою константи нестійкості:
Кн = 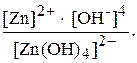
Константа нестійкості комплексного іона характеризує міцність (стійкість) внутрішньої сфери комплексної сполуки.
Експериментальна частина
Дослід 6.2.1. Дисоціація подвійної солі
У три пробірки помістити по 3 краплі розчину залізо-амонійних галунів (NH4)2SO4 ∙ Fe2(SO4)3. В одну пробірку додати 5 крапель розчину натрій гідроксиду. Закрити пробірку ватним тампоном, на який покласти вологий синій лакмусовий папірець. Нагріти. Що спостерігається ? У другу пробір-ку – додати 2 краплі розчину калій роданіду. Відзначити колір розчину. Написати рівняння реакцій. Скласти рівняння електролітичної дисоціаціі залізо-амонійних галунів.
Дослід 6.2.2. Відновлення Fe (III) в іоні [Fe (CN) 6] 3-
до Fe (II) в [Fe(CN)6] 4-
До 2-3 крапель розчину К3[Fe(CN)6] додайте 1-2 краплі ферум (III) хлориду. Спостерігати забарвлення розчину. Додати 2-3 краплі гідроген пероксиду і 1-2 краплі калій гідроксиду. Що відбувається ? Скласти рівняння реакцій у молекулярній і іонній формах.
Дослід 6.2.3. Утворення аміакатів цинку та кадмію
В одну пробірку внести 2-3 краплі розчину солі цинку, в іншу-2-3 краплі розчину солі кадмію. Потім в кожну пробірку додати по одній краплі розчину амоніаку до розчинення осадів основних солей, що утворились, і утворення розчинних аміакатів цинку і кадмію (координаційне число Zn2+ дорівнює 4, Cd2+ – 6). Скласти рівняння реакцій.
Дослід 6.2.4. Утворення аміакату нікелю
До 3 крапель розчину солі нікелю додати по краплях розчин амоніаку до розчинення осаду основної солі, що утворився. Визначити колір отриманого розчину. Записати рівняння реакцій (координаційне число Ni2+ дорівнює 6.)
Дослід 6.2.5. Стійкість іона диамінсрібла (I)
Внести у дві пробірки по 2-3 краплі розчину аргентум нітрату і додати в одну пробірку кілька крапель розчину лугу, в іншу – декілька крапель розчину калій йодиду. Визначити колір осаду, що утворюється. Записати рівняння реакцій. У дві інших пробірки внести по 2-3 краплі розчину аргентум нітрату і потім долити в обидві пробірки концентрований розчин амоніаку до розчинення осадів. До отриманого розчину комплексної сполуки срібла додати: в одну пробірку декілька крапель розведеного розчину лугу, в іншу – декілька крапель розчину калій йодиду. Пояснити відсут-ність осаду в першій пробірці і наявність жовтого осаду в другій. Скласти рівняння реакцій.
6.3. Контрольні запитання
| 1. | Для кожної з вказаних сполук вкажіть комплексоутворювач, його заряд і координаційне число, назвіть ліганди, вкажіть внутрішню та зовнішню сфери комплексу. Запишіть рівняння електролітичної дисоціації комплексних сполук та запишіть вираз для їх констант нестійкості. Дайте назви сполукам а) [Ag(NH3)2]Cl; б) Na3[AlF6]; в) K[Ag(CN)2]; г) [Cu(NH3)2]Cl. |
| 2. | Класифікація координаційних сполук. Назвати речовини та вказати їх тип: а) [Ag(NH3)2]NO2; б) [Co(H2O)6]Cl2; в) K[Ag(CN)2]; г) Na3[Cr(OH)6]. |
| 3. | Напиcати рівняння первинної і вторинної дисоціації таких комплексних солей: К2[Zn(OH)4], [Cu(NH3)4]Cl2, (NH4)2[Cо(SСN)4], [Ag(NH3)2]NO3. |
| 4. | Напиcати рівняння дисоціації та скласти вираз для константи нестійкості наступних координаційних сполук: К[Au(CN)2], [Cu(NH3)4]Cl2, [Pt(NH3)2Cl2], К2[НgJ4]. |
| 5. | Координаційна теорія Вернера. Назвати сполуки та визначити ступінь окиснення та координаційне число комплексоутворювача в сполуках: а) [Ag(NH3)2]Cl; б) K4[TiCl8]; в) K[Ag(CN)2]; г) K2[PtCl4]. |
| 6. | Що таке координаційне число комплексоутворювача і як воно визначаться ? Відповідь підтвердити конкретним прикладом. |
| 7. | Пояснити будову комплексних сполук: а) що входить до складу внутрішньої координаційної сфери ? б) із чого складається зовнішня координаційна сфера ? |
ЛАБОРАТОРНА РОБОТА № 7
ХІМІЯ S-ЕЛЕМЕНТІВ
Теоретична частина
Гідроген належить до найпоширеніших елементів у природі. У вільному стані він зустрічається в незначних кількостях, головним чином, у верхніх шарах атмосфери, тому що густина вільного водню у 14,5 разів менша, ніж густина повітря. Вільний водень виділяється при виверженні вулканів, з бурових свердловин та при розкладанні бактеріями органічних речовин в умовах нестачі повітря.
Лабораторні способи одержання водню полягають у витісненні його із води або розведених кислот, що не виявляють окисних властивостей.
1. Дією розведених кислот на метали:
Fe + H2SO4 → FeSO4 + H2↑
Zn + 2HCl → ZnCl2 + H2↑
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
З кислот можуть витісняти водень лише ті метали, які в ряду активності займають місця ліворуч від Гідрогену. Причому чим лівіше знаходиться метал в ряду, тим він більш активний. Так лужні і лужноземельні метали дуже активні, при їх взаємодії з кислотами спостерігається вибух. Тому при одержанні водню в лабораторних умовах користуються металами середньої активності – цинком або залізом.
2. Взаємодією лужних і лужноземельних металів з водою:
2K + 2H2O → 2KOH + H2↑
Ca + 2H2O → Ca(OH)2 + H2↑
3. У промисловості для добування водню використовують природні та нафтозаводські гази, складовою частиною яких є метан. Природний газ змішують з киснем у кількості, яка недостатня для повного окиснення метану, і проводять реакцію при 850 - 900°С у присутності каталізатора (Ni + Al2O3):
2CH4 + O2 → 2CO↑ + 4H2↑ + 71,4 кДж.
Молекулярний Гідроген може виявляти відновні властивості по відношенню до окисників неметалічного походження, а також по відношенню до окиснених форм металів.
При звиайних умовах Гідроген малоактивний завдяки стійкості молекул Н2 і безпосередньо взаємодіє лише з фтором: H2 + F2 ® 2HF, а під дією світла відбувається ланцюгова реакція з хлором: H2 + Cl2 ® 2HCl.
У сіміші з киснем водень горить голубим полум’ям з виділенням великої кількості тепла:
2H2 + O2 → 2H2O + 575.4 кДж.
Відновна здатність водню використовується у металургії для одержання деяких високочистих металів з їх оксидів:
Ag2O + H2 → 2Ag + H2O;
CuO + H2 → Cu + H2O;
MoO3 + 3H2 → Mo + 3H2O.
У реакціях з активними металами (лужні, лужно-земельні) водень утворює гідриди. У цих реакціях атом водню приєднує електрон, перетворюючись у негативно заряджений іон з оболонкою інертного газу гелію:
2Na + H2 → 2NaH
Гідриди – солеподібні, тверді, кристалічні речовини з іонним зв’язком. Вони виявляють дуже сильні відновні властивості і легко розкладаються водою, кислотами та взаємодіють з іншими різними окисниками:
CaH2 + 2H2O → Ca(OH)2 + 2H2
До найважливіших оксидів Гідрогену відноситься вода. Організми тварин і рослин містять від 50 до 90 % (макс.) води. Вода потрібна рослинам протягом усього їх життя. Починаючи з проростання насіння вода обумовлює важливі біохімічні процеси. Встановлено, що хлібні злаки витрачають до 300 кг води на 1 кг сухої рослинної маси. Для отримання високого урожаю необхідно в достатку забезпечити культурну рослину вологою. Частково це досягнення агротехнічними прийомами; після прибирання хлібів лущать стерню, прагнучи “закрити” вологу, тобто припинити сильний випар води з грунту. У областях, що відрізняються недостатнім зволоженням, багато уваги приділяється зрошуванню, що дозволяє істотно підвищити урожай сільськогосподарських культур. Взагалі гідромеліора-тивні роботи завжди пов’язані з підвищенням врожайності сільськогоспо-дарських культур і освоєнням нових земель.
Окрім води Гідроген утворює з Оксигеном ще одну сполуку – гідроген пероксид Н2О2. Він застосовується головним чином завдяки його сильній окисній дії. У агрономічних і грунтових лабораторіях гідроген пероксид використовують для озолення (спалювання) зразків грунту або рослинного матеріалу.
Натрій та Калій є елементами ІА групи періодичної системи і відносяться до лужних металів. Атоми цих елементів мають на зовнішньому рівні по одному s-електрону, які вони легко віддають під час хімічних реакцій, перетворююючись на позитивно заряджені іони (ступінь окиснення +1). Зі збільшенням радіуса атома (Na, K) виникає збільшення відновних і металічних властивостей, зростають електропровідність, густина та хімічна активність.
Металічний Натрій і Kалій одержують електролітичним відновленням розплавлених солей або відповідних гідроксидів. При цьому на катоді проходить реакція відновлення:
Me+ + е- → Meо
З елементами IIА і IIIА груп та між собою лужні метали утворююють сплави, з галогенами – лише найпростіші бінарні сполуки, з вуглецем – ацетиленіди, з сіркою – сульфіди і полісульфіди, з фосфором – фосфіди, кремнієм – силіциди, з водою – гідроксиди:
2Na + Cl2 → 2NaCl
2К + S → К2S
2Na + O2 → Na2O2
2Na + 2C → 2Na2C2
2K + 2H2O → 2KOH + H2↑
В атмосфері кисню ці метали згоряють, а при нагріванні спалахують утворюючи оксиди та пероксид чи надпероксид:
2Na + O2 → Na2O2 – натрій пероксид
K + O2 → KO2 – калій надпероксид
Пероксиди і надпероксиди підлягають гідролізу:
Na2O2 + 2H2O → 2NaOH + H2O2
2KO2 + 2H2O → 2KOH + H2O2 + O2
Оксиди лужних металів також реагують з водою з утворенням гідроксидів:
Na2O + H2O → 2NaOH
NaOH і KOH – безбарвні кристалічні речовини, добре розчиняються у воді з виділенням великої кількості тепла. Розчини цих гідроксидів називають лугами.
При слабкому нагріванні калію та натрію в атмосфері водню утворю-ються гідриди. Наявність в гідридах Гідрогену зі ступенем окиснення -1 надає їм сильні відновні властивості, які виявляються в реакціях з водою, кислотами та іншими окисниками:
NaH + H2O → NaOH + H2
КН + HCl → KCl + H2
NaH + Cl2 → NaCl + HCl
2KH + CO2 → 2KOH + C
При взаємодії твердих бінарних сполук з оксидами, сульфідами, гало-генідами утворюються солі:
Na2O + CO2 → Na2CO3
K2O + SiO2 → K2SiO3
У сільському господарстві використовують як добрива натрій нітрат (чилійська селітра) та калій хлорид. Калій сульфат – калійне добриво, що використовується для вирощування культур, які не витримують надлишку хлоридів. Натрій хлорид підсилює ріст і розвиток буряків, сприяє швидкостиглості рослин. Є відомості про те, що натрій активізує переміщення калію до молодих частин рослин і підвищує ефективність калію, азоту та інших поживних речовин. Калій потрібен рослинам для постачання клітин водою, забезпечення проникності клітинних мембран. Якщо його достатньо – рослина краще утримує воду, стійка до засухи і заморозків.
Магній та Кальцій, що утворюють ІІА-групу періодичної системи, також відносяться до s-елементів. Атоми цих елементів на зовнішньому рівні мають по два електрони в стані s2. Всі елементи ІІА групи зустрічаються у природі лише у вигляді сполук. Кальцій та Магній є найважливішими біогенними елементами. Вони також входять до складу важливих первинних і грунто-утворюючих мінералів і є необхідними елементами грунтового харчування рослин.
