Стійкість комплексних йонів. Констаети нестійкості та стійкості. Розрахунки у розчинах комплексних сполук.
Комплексними називаються сполуки, у вузлах кристалічних граток яких містяться складні іони, побудовані за рахунок координації певних частинок навколо центрального атома та здатні до самостійного існування після переходу у розчинений чи розплавлений стан.
Комплексні сполуки широко використовують як в якісному, так і в кількісному аналізі речовин. Найчастіше їх застосовують у гравіметричному, титриметричному, спектрофотометричному аналізі, при маскуванні сторонніх йонів та розчиненні осадів.
В молекулі комплексної сполуки центральне положення займає позитивно заряджений йон, який називається комплексоутворювачем. З ним зв’язані йони або молекули, які називають лігандами. Разом з центральним йоном ліганди утворюють внутрішню сферу комплексної сполуки, яку при написанні беруть у квадратні дужки. Йони, що розміщуються за внутрішньою сферою утворюють зовнішню сферу комплексної сполуки.
У водних розчинах комплексні сполуки дисоціюють за типом сильного електроліту на прості та комплексні йони. В свою чергу комплексні йони у водному розчині дисоціюють як слабкі електроліти.
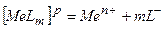 .
.
Міцність комплексних йонів характеризується константами нестійкості комплексу.
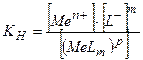 ,
,
де 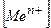 - рівноважна концентрація йонів комплексоутворювача;
- рівноважна концентрація йонів комплексоутворювача;
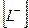 - рівноважна концентрація йонів ліганду в ступені, що дорівнює координаційному числу – m;
- рівноважна концентрація йонів ліганду в ступені, що дорівнює координаційному числу – m; 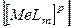 - рівноважна концентрація комплексного йона в розчині; р – заряд комплексного йона.
- рівноважна концентрація комплексного йона в розчині; р – заряд комплексного йона.
Комплексний йон тим стійкіший, чим менша його константа нестійкості. Величини констант нестійкості залежать від природи комплексу і температури.
У розведених водних розчинах більшість комплексних сполук піддається первинній дисоціації на внутрішню та зовнішню сфери. При цьому комплексний йон. Що утворюється, поводить себе як єдине ціле:
[Ag(NH3)2]Cl ↔ [Ag(NH3)2]+ + Cl-
K[Ag(CN)2] ↔ K+ + [Ag(CN)2]-
Поряд з цим процесом незначною мірою проходить вторинна дисоціація- розкладання внутрішньої сфери комплексу на складові частини:
[Ag(NH3)2]+ ↔ Ag+ + 2NH3,
[Ag(CN)2]- ↔ Ag+ + 2CN-.
Оскільки комплексний йон виявляє себе як дуже слабкий електроліт, вторинна дисоціація підлягає закону діючих мас. Тому можна записати вираз константи рівноваги, яка у даному випадку називається константою нестійкості комплексного йона:
Кнест.[Ag(NH3)2]+ = [Ag+] [NH3]2/ [[Ag(NH3)2]+ ] = 6×10-8,
Кнест. [Ag(CN)2]-= [Ag+] [CN-]2/ [[Ag(CN)2]- ] = 10-22.
Константа нестійкості є мірою міцності внутрішньої сфери: чим меншу величину має Кнест., тим міцніший комплекс. Отже, з двох наведених вище прикладів більшу стійкість виявляє другий комплекс, оскільки йому відповідає менше значення константи нестійкості.
Іноді замість константи нестійкості використовують оюернену їй величину – константу стійкості:
Кст.= [[Ag(NH3)2]+ ] /[Ag+] [NH3]2=1,7×107,
Кст.= [[Ag(CN)2]- ] /[Ag+] [CN-]2=1022.
Більшому значенню константи стійкості відповідає більша концентрація комплексоутворювача у розчині під час стану рівноваги.
Детальніше вивчення комплексних сполук довело, що цей процес відбувається ступінчасто. Наприклад, від комплексного йона [Ag(NH3)2]+ відщеплюється спочатку одна молекула аміаку:
[[Ag(NH3)2]+↔ [Ag(NH3)]+ + NH3.
Рівновага першого ступеня характеризується константою
Кнест.1=[[Ag(NH3)]+] [NH3] / [[[Ag(NH3)2]+]=6×10-4.
Потім відривається друга молекула аміаку:
[Ag(NH3)]+ ↔ Ag+ + NH3.,
Чому відповідає константа нестійкості другого ступеня:
Кнест.2= [Ag+] [NH3] / [[Ag(NH3)]+]=1×10-4.
Добуток констант нестійкості за першим та другим ступенями дає загальну константу константу нестійкості комплексу в цілому:
Кнест.[Ag(NH3)2]+ = Кнест.1 Кнест.2 =6×10-4×1×10-4=6×10-8.
Деякі комплексні сполуки мають дуже нестійку внутрішню сферу і досить великі значення констант нестійкості (>10-1). До таких сполук, у першу чергу, належать подвійні солі, які у твердому стані та у висококонцентрованих розчинах мають структуру, а у розведених розчинах значною мірою розпадаються на йони, наприклад:
K2[CuCl4] ↔ 2K+ + Cu2+ + 4Cl-.
Задача
Дано:
с( СН3СООН)=0,1моль
с(СН3СООNa)=0,1 моль
Кд(СН3СООН)=1, 86×10-5
РН-?
Розв’язання:
рН=рКа(к-ти) - lg (C(к-ти)/С(солі))
рКа(к-ти)= - lgКд(к-ти)= - lg 1, 86×10-5=4, 73
рН=4,73- lg 0,1/0,1= 4,73.
Відповідь:4.73
Другої частини задачі незнаю(
Білет №25
1. Методи аналітичної хімії.
Хімічні й фізико хімічні методи аналізу.
Загальна схема хімічних і фізико-хімічних методів аналізу зводиться до того, що досліджувану речовину переводять у розчин, діють певним хімічним реактивом і спостерігають зовнішній ефект хімічного перетворення. У складних випадках (при великій кількості складових елементів) суміш спочатку розділяють на окремі групи. Щоб визначити мікро кількість елементів, слід виділяти їх перед визначенням з великого об’єму розчину в невеликий об’єм органічного розчинника або осаду з метою підвищення чутливості визначення і позбавлення шкідливого впливу сторонніх елементів.
Отже, в загальному випадку хімічний аналіз складається з таких етапів:
-переведення досліджуваної речовини в розчин;
-відділення елементів, що визначаються, від інших та їх концентрування;
-якісне виявлення і кількісне визначення.
Кожний з цих етапів характеризується певною системою методів.
Методи хімічною аналізу за основними типами хімічних реакцій:
1)реакції осадження;
2)реакції утворення комплексних сполук;
3)реакції окислення-відновлення;
4)реакції кислотно-основної взаємодії.
У хімічному аналізі реакції різних типів часто поєднуються між собою. Наприклад, реакція між сульфатом міді й йодидом калію
2CuSO4 + 4KI = 2CuI + I2 + 2K2SO4
одночасно є окислювально-відновною і хімічною реакцією першого типу.
1. Реакції осадження є основою різних методів розділення, концентрування і визначення окремих іонів або елементів.
Методи розділення:
-хроматографічний аналіз (полягає у тому, що розчин складної суміші неорганічних або органічних речовин пропускають через колонку, заповнену адсорбентом, внаслідок чого суміш розділяється на окремі компоненти).
Методи концентрування:
-співосадження (полягає у тому, що осад при утворенні захоплює з розчину сторонні розчинні речовини). Використовується для вилучення з великого об’му розчину невеликих кількостей елементів, що визначаються, і для відділення останніх від основного компонента проби.
Методи виявлення і визначення:
-гравіметричний метод (полягає у тому, що визначувані іони вилучають з розчину у вигляді малорозчинної сполуки добавлянням певного реактиву, за масою осаду обчислюють кількість елемента або іона).
2.Реакції утворення комплексних сполук.
Методи розділення і концентрування:
-метод екстракції (метод розділення, який полягає в переведенні комплексної сполуки певного елемента з водного розчину в шар органічного розчинника). Застосовується переважно для переведення в органічний розчинник сполук комплексного характеру.
Методи виявлення і визначення:
-фотометричний метод (вимірювання інтенсивності забарвлення комплексних сполук, що утворюються при взаємодії визначуваних іонів з неорганічними або органічними реактивами;
-гравіметричний аналіз;
-титриметричний аналіз (до розчину визначуваних іонів добавляють точно еквівалентну кількість розчину реактиву відомої концентрації, вимірюється об’єм розчину реактиву і за рівнянням хімічної реакції обчислюють кількість визначуваних іонів).
3.Реакції окислення-відновлення
Методи розділення і концентрування:
-метод цементації (відновлення металами іонів металів, що містяться в розчині);
-електроліз на ртутному катоді (іони багатьох елементів відновлюються електричним струмом до металів, які розчиняються у ртуті, утворюючи амальгами, іони інших металів залишаються при цьому в розчині). Застосовується, наприклад, для відділення цинку від алюмінію, заліза від титану та інш.
Методи виявлення і визначення:
-титриметричний методи – перманганатометрія, йодлметрія, хроматометрія та інш. (ґрунтуються на використанні різних окислювачів та відновників);
-електрогравіметричний аналіз (іони металів, що є в розчині, відновлюються електричним струмом до металічного стану). Застосовується для визначення Cu, Cd, Zn, Co, Pb, Ag, Au та інш.;
-каталітичні методи аналізу (швидкість реакції є основою для кількісного визначення елементів, які каналізують реакцію. Швидкість реакції збільшується пропорційно концентрації каталізатора.). Дуже чутливий аналіз, надає можливість визначення десятих та сотих часток мікрограма речовини;
-полярографічний метод (ґрунтується на вимірюванні сили граничного струму, що пропорційна концентрації речовини, що відновлюється. У розчин занурюють два електроди, які з’єднуються з джерелом постійного струму і поступово підвищують напругу на електродах.). Застосовується в аналізі металів та сплавів, придатний і для аналізу руд, природних вод, біологічних об’єктів, гірських порід, силікатів тощо;
-кулонометричний метод (кількість речовини визначають за кількістю електрики, яку треба витратит на електрохімічне перетворення – окислення або відновлення – речовини). Цим методом визначаються незначні кількості речовини – до сотих і тисячних часток мікрограма.
4.Кислотно-основні реакції:
-метод титриметричного аналізу – метод нейтралізації.
Фізикохімічні методи аналізу:
-фотоколометричний аналіз;
-спектроколометричний аналіз;
-нефелометричний аналіз;
-потенциометричний аналіз;
-кондуктометричний аналіз;
-полярографічний аналіз.
Фізичні методи аналізу.
У фізичних методах аналізу кількість речовини визначають вимірюванням параметра певної фізичної властивості речовини, причому хімічні реакції або зовсім не проводяться, або мають другорядне значення. До фізичних властивостей відносяться густина речовини, теплопровідність, колір, електропровідність, твердість, радіоактивність тощо.
Методи фізичного аналізу:
1.Спектральний метод – матеріал, що аналізують, піддають дії високої температури електричної іскри або електричної дуги, що призводить до випромінювання світла атомами елемента. Це випромінювання розкладають спектрографом на складові і фотографують. Порівнявши інтенсивність окремих ліній спектра еталона з точно відомим вмістом окремих елементів, можна визначити ці елементи.
2.Метод фотометрії полум’я – розчин речовини, яку аналізують, вводять у полум’я газового пальника, розчинник випаровується, електрони переходять на основний енергетичний рівень, що супроводжується випромінюванням, яке фіксується фотоелементом і інтенсивність якого за певних умов пропорційна вмісту даного елементу в пробі. Метод придатний тільки для визначення лужних і лужноземельних металів.
3.Метод атомної абсорбції –ґрунтується на поглинанні квантів світла від спеціального джерела не збудженими атомами елементів у полум’ї. Вміст елементу визначають, вимірявши зменшення інтенсивності світла при проходженні його через полум’я. Перевага цього методу – висока селективність і чутливість.
4.Рентгено-флуоресцентний метод – на пробу діють рентгенівськими променями. Інтенсивність вторинного випромінювання залежить від кількості даного елемента в пробі.
5.Радіоактиваційний метод – досліджуваний матеріал піддають дії нейтронного випромінювання в атомному реакторі. Порівнюючи інтенсивність радіоактивного випромінювання окремих фракцій еталоннох проби і досліджуваного матеріалу, роблять висновок про кількісний вміст окремих елементів. Цей метод дуже чутливий (можна визначати елементи, вміст яких становить 10-8-10-10%).
6.Нейтронно-активізаційний.
7.Еміссіонний (плазменна фотометрія).
8.Ядро-магнітний резонанс.
