Общая минерализация и ионная сила природной воды
Главные ионы в основном формируют ионный состав природной воды. Общее содержание солей в природной воде характеризуют таким параметром, как общая минерализация. Общая минерализация — это массовая концентрация всех растворенных в природной воде солей, при условии, что гидрокарбонаты превращаются в карбонаты. Обычно общую минерализацию определяют следующим образом: упаривают 1 л отфильтрованной воды, высушивают остаток при 105°С и взвешивают его. Общая минерализация природных вод колеблется от 10 –15 мг/л в дождевых водах, тундровых озерах и водах верховых болот до 200 г/л в бессточном Мертвом море и заливе Кара –Богаз –Гол.


Растворенные в воде соли вызывают осмотические явления, влияют на конфигурацию белков, а также скорости и равновесия ионных реакций. Это влияние обусловлено электростатическими взаимодействиями с участием ионов. Влияние электростатических взаимодействий на химические и биологические процессы в растворе определяется его ионной силой (измеряется в моль/л), вычисляемой по формуле:
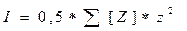
где Z — ион, z — его заряд, [Z] — молярная концентрация иона Z.
Для природной воды ионную силу можно приближенно вычислить по формуле:
I= 0,5 • ([Na+] + [К+] + [Са2+] . 4 + [Mg2+] . 4 + [HCO3 –] + [Сl –] + [SO42 –] . 4),
где [Na+] – молярная (моль/л) концентрация ионов Na+ и т.д.
Поскольку ионная сила зависит от квадрата заряда иона, в растворе сульфата магния (MgSO4) она будет в 4 раза больше, чем в растворе хлорида натрия (NaCl) той же молярной концентрации.
Влияние растворенных солей на конфигурацию белков. Белки состоят из сложных молекул и выполняют множество жизненно важных функций. Свойства молекул белков зависят от конфигурации, то есть от взаимного расположения тех или иных фрагментов молекулы в пространстве. Кроме того, разные участки белковой молекулы могут быть заряжены. Эти заряды притягиваются, либо отталкиваются друг от друга, поддерживая, таким образом, определенную конфигурацию молекулы. Если ионы, находящиеся в растворе, скомпенсируют заряды на молекуле белка, то заряженные фрагменты перестанут притягиваться (отталкиваться). Молекула белка изменит конфигурацию, (как говорят, белок свернется) и потеряет свои функции. Из –за того, что в присутствии соли белок сворачивается лучше, чем в ее отсутствие (при одинаковой температуре) яйца варят в подсоленной воде, чтобы, если образуется трещина, вытекающий белок сразу же свернулся и закупорил трещину.
Влияние растворенных солей на осмотические явления. С осмотическими явлениями сталкивался всякий, кто посыпал фрукты сахаром или солил капусту. Если какой –нибудь сочный фрукт засыпать сахаром, то наружу будет выделяться сок. То же самое происходит с капустой, если посыпать ее солью. Причина в том, что любая клетка отделена от окружающего пространства полупроницаемой мембраной. Молекулы воды она пропускает, а ионы, как правило, нет. Если с двух сторон полупроницаемой мембраны находятся растворы с разной ионной силой, вода начнет переходить из раствора с меньшей ионной силой в раствор с большей, так, чтобы ионная сила растворов в итоге сравнялась.
Такое явление (проникновение растворителя из более разбавленного раствора в более концентрированный через полупроницаемую мембрану) называется осмосом (от греческого слова ώσμος — давление). Поэтому, если клетку, не имеющую специальных систем противодействия осмосу, поместить в рассол, внутриклеточная вода будет выходить наружу, и клетка останется без воды. Если же клетку поместить в дистиллированную воду, то вода снаружи начнет разбавлять внутриклеточную жидкость, то есть вода начнет втягиваться в клетку. Дело кончится тем, что клетка лопнет.
Влияние на взвеси. В природных водах часто существуют довольно устойчивые взвеси мелких частиц. Поверхность этих частиц часто несет на себе небольшой электростатический заряд, поэтому они не слипаются. Если же в растворе присутствуют соли, то их ионы нейтрализуют поверхностный заряд, частицы слипаются и выпадают в осадок. Именно поэтому морская вода обычно гораздо прозрачнее озерной.
Влияние на скорости и равновесия реакций с участием ионов. Если в раствор, в котором происходят реакции с участием заряженных частиц, ввести какой – либо фоновый электролит, то он будет «расталкивать» разноименные частицы и «стягивать» одноименные (см. рис.).
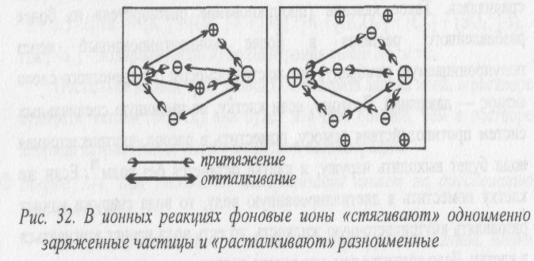
Поэтому при высокой ионной силе реакции, связанные с объединением разноименных ионов, затрудняются, а с объединением одноименных — наоборот, облегчаются. В результате происходит смещение равновесий с участием заряженных частиц. Например, электролитическая диссоциация в присутствии фонового электролита (то есть при высокой ионной силе раствора) облегчается. Поэтому в присутствии фоновых электролитов все кислоты становятся несколько сильнее, причем, чем больше заряд образующегося аниона, тем сильнее становится кислота.
Организмы и ионная сила внешней среды. Поскольку ионная сила влияет на конфигурацию белков, а также на скорости и равновесия реакций в организме, все организмы вынуждены поддерживать внутри себя постоянную ионную силу даже при колебании ионной силы внешней среды. Поэтому в любом организме существуют специальные механизмы поддержания постоянства ионной силы. Они сводятся либо к выкачиванию излишней воды, либо к выведению избытка солей. Чем больше разница ионной силы внутри и вне организма, тем больше энергии требуется для поддержания постоянства внутренней ионной силы. Поэтому для водных организмов существует некий диапазон ионной силы внешней среды, в котором эти организмы могут существовать.
Растворенные газы
Азот. Основной источник и сток азота — атмосфера. Сам по себе молекулярный азот, будучи химически инертным, не влияет практически ни на какие процессы в водоеме. Однако, если в водоеме присутствуют организмы – азотфиксаторы, (например, цианобактерии, они же сине –зеленые водоросли), то азот будет превращаться ими в соединения, доступные живым организмам.
Кислород. Кислород поступает в воду из двух источников — из воздуха в результате растворения и из водных растений в результате фотосинтеза, а расходуется на дыхание живых организмов и разложение их остатков. Малые количества кислорода, которые растворены в воде, обеспечивают возможность жизни водных организмов. Кроме того, растворенный в воде кислород обеспечивает разложение их останков. Если у водоема плохой газообмен с воздухом и в нем находится много останков отмерших организмов, то кислород оказывается в дефиците. В этом водоеме органические остатки окисляются не полностью. В результате неполного окисления образуются летучие соединения серы в степени окисления –2 и азота –3. Эти соединения придают воде специфический запах тины.
В бурных горных реках, где вода постоянно перемешивается с пузырьками воздуха, газообмен между водой и воздухом очень хорош. Концентрация кислорода в такой воде обычно максимальна, а органические соединения быстро окисляются. Именно в таких реках водится форель — рыба, весьма требовательная к наличию кислорода и чувствительная к органическим загрязнениям. Во время штормов обогащается кислородом вода морей, озер и крупных рек. А вот в глубоких стоячих водоемах газообмен затруднен, и концентрация кислорода в них может быть невысокой. Кроме того, газообмен сильно затруднен зимой, когда водоем покрыт льдом. Нефтяные, масляные и бензиновые пленки тоже сильно затрудняют газообмен.
Углекислый газ. Источников углекислого газа в гидросфере три — воздух, дыхание водных организмов и разложение их останков. Расходуется углекислый газ на фотосинтез, а также на выщелачивание горных пород. В ходе фотосинтеза водные растения могут усваивать не только растворенный углекислый газ, но и гидрокарбонат –ионы, хотя и менее эффективно, поэтому углекислый газ в гораздо меньшей степени лимитирует развитие водных организмов, чем кислород.
Углекислый газ, растворенный в воде, переводит в воду ряд элементов из подстилающих горных пород и нейтрализует попадающие в воду основания. Например, он нейтрализует аммиак, образующийся при разложении мочевины, попадающей в воду в результате жизнедеятельности организмов:
(H2N)2CO + 2Н2О = NH3 + NH4HCO3
NH3 + СО2 + Н2О = NH4HCO3
В водном растворе углекислый газ находится в равновесии с угольной кислотой, причем равновесие сильно смещено в сторону СО2 (отношение Н2СО3:СО2 << 1:300). Это равновесие устанавливается довольно быстро (в течение нескольких минут).
