Образование хелатных комплексов. Характеристика лиганд (хелатирующих агентов). Сродство, коэффициент устойчивости.
Известно много веществ (лигандов), способных связываться с металлами. Они часто образуют с ними хелатные соединения. Если металл оказывается заключенным в лиганде между такими элементами, как N, О или S, то образуется хелатное кольцо.
Понятие «лиганд» относится не ко всем находящимся в системе молекулам органического соединения, а только к их части, находящейся в соответствующей форме, которая может связывать катион металла.
В зависимости от количества вступивших во взаимодействие атомов металлов и лигандов могут образовываться комплексы 1:1, 1:2 и др.
Образование комплексов в стехиометрическом соотношении 1:1. Три основных типа лигандов, образующих одно кольцо в комплексе 1:1 (бидентатные лиганды):
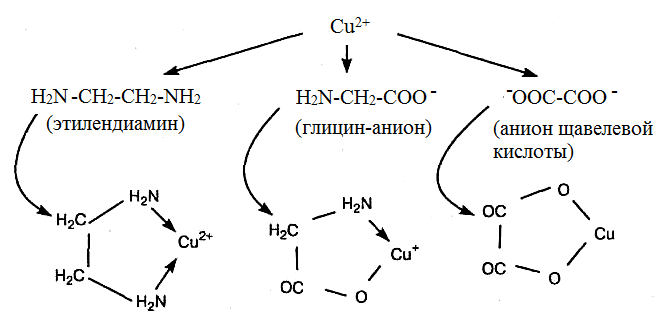
Стрелки в кольце показывают направление смещения неподеленной в норме пары электронов от атомов О, N или S к металлу.
а) если лиганд содержит две электрондонорные группы (этилендиамин), то заряд катиона металла при образовании хелатного соединения не меняется;
б) если лиганд содержит одну электронодонорную и одну анионную группу (глицин), то заряд металла уменьшается на единицу;
в) если, лиганд содержит две анионные группы (щавелевая кислота), то заряд металла уменьшается на две единицы.
Хелатные связи с атомами кислорода и азота возникают, обычно, в случае образования пяти- и шестичленных циклов (такие циклы значительно стабильнее). Однако при образовании хелатных связей через серу возникают устойчивые четырехчленные циклы.
Образование комплексов в стехиометрическом соотношении 2:1. Такие комплексы могут образовываться в присутствии избытка лигандов.
Образование комплексов 2:1 обусловлено тем, что:
– комплексы щавелевой кислоты 1:1 могут соединяться в дальнейшем с комплексом этилендиаминового типа, образуя смешанные комплексы;
– комплексы 1:1 глицинового типа способны соединяться с другими лигандами этого типа;
– комплекс 1:1, образованный лигандами, подобными этилендиамину, может соединяться с любым из трех типов лигандов, образующих комплексы 1:1.
Для оценки прочности связей применяют константы устойчивости, характеризующие равновесие между одним или несколькими лигандами и одним ионом металла, подчиняющееся закону действия масс. Так, для комплекса в соотношении 1:1 константа устойчивости (θ) рассчитывается по формуле:
[MeX]
ϴ = –––––––– .
[Me] [X]
В приведенном уравнении в числителе находится значение концентрации комплекса, а в знаменателе – значение концентраций образующих его компонентов.
Факторы, влияющие на хелатообразование:
1) радиус иона. Металлы по своему сродству к большинству хелатирующих агентов располагаются в следующем порядке (от наибольшего сродства к наименьшему): Fe3+, Hg2+, Cu2+, Al3+, Ni2+, Pb2+, Co2+, Zn2+, Fe2+, Cd2+, Mn2+, Mg2+, Ca2+, Li+, Na+, K+.
В ряду металлов, являющимся первым рядом переходных элементов, 25Мn, 26Fe, 27Со, 28Ni, 29Сu, 30Zn сродство к хелатирующим агентам последовательно увеличивается, достигая максимума у меди (Сu2+). Повышение сродства к хелатирующим агентам является следствием уменьшения ионного радиуса.
С увеличением заряда катиона металла происходит уменьшение его радиуса, поэтому Fe3+ имеет большее сродство, чем Fe2+ (ионы трехвалентных металлов располагаются в начале ряда, а одновалентных – в конце).
2) степень ионизации хелатообразуншшх агентов. Вещество, обладающее меньшим сродством к металлу, может присоединить большее количество катионов металла, чем вещества, у которых это сродство больше. Это объясняется тем, что для хелатообразования необходимо не только наличие сродства между лигандом и металлом, но также быстрое образование анионов лиганда из агента (или молекул лиганда), т. е. зависит от значения константы ионизации.
3) химическая природа лиганда. Большинство металлов легче соединяются с лигандами, содержащими кислород, а не серу. Однако Cu+, Ag+, Hg2+, As+ и Sb3+ отдают предпочтение сере; у Cu2+, Ni2+ и Со2+ сродство к сере несколько выше, чем к кислороду, если сера находится в неионизированном состоянии, как, например, в органических сульфидах.
4) изменение окислительно-восстановительного потенциала металла, вызванное образованием хелатных соединений с металлами, имеющими переменную валентность (например, Сu, Fe, Co, Мn, Мо, 5). Вследствие хелатообразования такие металлы могут даже изменять первоначальную валентность.
Металл может изменять избирательность органического лиганда:
– влияя на распределение электронов в лиганде;
– повышая реакционную способность активного центра лиганда;
– вызывая изменение конформации лиганда;
– обеспечивая возможность присоединения или отрыва электрона;
– увеличивая липофильность лиганда и, следовательно, его способность проникать в живую клетку.
