Механизм электролитической диссоциации.
Главная причина диссоциации – поляризационное взаимодействие полярных молекул растворителя с молекулами растворенного вещества.Например, молекула воды – полярна, ее дипольный момент μ = 1,84 D, т.е. она обладает сильным поляризующим действием. В зависимости от структуры растворяющегося вещества в безводном состоянии его диссоциация протекает по-разному. Наиболее типичны два случая:

Рис. 4.8 Растворение вещества с ионной кристаллической решеткой
1. Растворенное вещество с ионной связью (NaCl, KCl и т.д.). Кристаллы таких веществ уже состоят из ионов. При их растворении полярные молекулы воды (диполи) будут ориентироваться к ионам своими противоположными концами. Между ионами и диполями воды возникают силы взаимного притяжения (ион-дипольное взаимодействие), в результате связь между ионами ослабевает, и они в гидратированном виде переходят в раствор (рис. 4.8). В рассматриваемом случае одновременно с растворением происходит диссоциация молекул. Вещества с ионной связью диссоциируют легче всего.
2. Растворенное вещество с полярной ковалентной связью (например, НCl, H2SO4, H2S и др.). Здесь также вокруг каждой полярной молекулы вещества ориентируются соответствующим образом диполи воды с образованием гидратов. В результате такого диполь-дипольного взаимодействия связующее электронное облако (электронная пара) практически полностью сместится к атому с большей электроотрицательностью, при этом полярная молекула превращается в ионную (стадия ионизации молекулы) и затем распадается на ионы, которые переходят в раствор в гидратированном виде (рис. 4.9). Диссоциация может быть полной или частичной – все зависит от степени полярности связей в молекуле.

ионизация диссоциация
Рис. 4.9 Растворение вещества с ковалентной полярной связью
Различие между рассмотренными случаями заключается в том, что в случае ионной связи ионы существовали в кристалле, а в случае полярной – они образуются в процессе растворения. Соединения, содержащие одновременно и ионные, и полярные связи, сначала диссоциируют по ионным, а затем по ковалентным полярным связям. Например, гидросульфат натрия NаНSО4 полностью диссоциирует по связи Na-O, частично – по связи H-O и практически не диссоциирует по малополярным связям серы с кислородом.
Таким образом, при растворении диссоциируют только соединения с ионной и ковалентной полярной связью и только в полярных растворителях.
Степень диссоциации. Сильные и слабые электролиты
Количественной характеристикой электролитической диссоциации является степень диссоциации электролита в растворе. Эта характеристика была введена Аррениусом. Степень диссоциации – α - это отношение числа молекул N, распавшихся на ионы, к общему числу молекул растворенного электролита N0:

α выражают в долях единицы или в %.
По степени диссоциации электролиты делят на сильные или слабые.
При растворении в воде сильные электролиты диссоциируют практически полностью, процесс диссоциации в них необратим. У сильных электролитов степень диссоциации в растворах равна единице (α=1) и почти не зависит от концентрации раствора.В уравнениях диссоциации сильных электролитов ставят знак “=” или “ 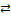 ”. Например, уравнение диссоциации сильного электролита сульфата натрия имеет вид
”. Например, уравнение диссоциации сильного электролита сульфата натрия имеет вид
Nа2SО4 = 2Nа+ + SО42-.
К сильным электролитам в водных растворах относятся почти все соли, основания щелочных и щелочноземельных металлов, кислоты: H2SO4, HNO3, HCl, HBr, HI, HСlO4, HClO3, HBrO4, HBrO3, HIO3, H2SeO4, HMnO4, H2MnO4 и т.д.
К слабым электролитам относятся электролиты, степень диссоциации которых в растворах меньше единицы (α<1) и она уменьшается с ростом концентрации.
Процесс диссоциации слабых электролитов протекает обратимо до установления равновесия в системе между нераспавшимися молекулами растворенного вещества и его ионами. В уравнениях диссоциации слабых электролитов ставят знак «обратимости». Например, уравнение диссоциации слабого электролита гидроксида аммония имеет вид
NН4+ОН 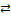 NН4+ + ОН-
NН4+ + ОН-
К слабым электролитам относят воду, почти все органические кислоты (муравьиную, уксусную, бензойную и т.д.), ряд неорганических кислот (H2SO3, HNO2, H2CO3, H3AsO4, H3AsO3, H3BO3, H3PO4, H2SiO3, H2S, H2Se, H2Te, HF, HCN, HCNS), основания p-, d-, f- элементов (Al(OH)3, Cu(OH)2, Fe(OH)2 и т.д.), гидроксид аммония, гидроксиды магния и бериллия, некоторые соли (CdI2, CdCl2, HgCl2, Hg(CN)2, Fe(CNS)3и т.д.).
В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% - средними, менее 3% - слабыми электролитами.
Численное значение степени электролитической диссоциации зависит от различных факторов:
1. Природа растворителя.
Это связано с величиной диэлектрической проницаемости растворителя ε. Как следует из закона Кулона, сила электростатического притяжения двух разноименно заряженных частиц зависит не только от величины их зарядов, расстояния между ними, но и от природы среды, в которой взаимодействуют заряженные частицы, т.е. от ε:
Например, при 298 К ε(Н2О) = 78,25, а ε(С6Н6) = 2,27. Такие соли, как KCl, LiCl, NaCl и др., в воде полностью диссоциированы на ионы, т.е. ведут себя как сильные электролиты; в бензоле эти соли диссоциируют лишь частично, т.е. являются слабыми электролитами. Таким образом, одни и те же вещества могут проявлять различную способность к диссоциации в зависимости от природы растворителя.
2. Температура.
У сильных электролитов с повышением температуры степень диссоциации уменьшается, у слабых – при повышении температуры до 60°С α увеличивается, а затем начинает уменьшаться.
3. Концентрация раствора.
Если рассматривать диссоциацию как равновесный химический процесс, то в соответствии с принципом Ле Шателье добавление растворителя (разбавление водой), как правило, увеличивает количество продиссоциированных молекул, что приводит к увеличению α. Процесс образования молекул из ионов в результате разбавления затрудняется: для образования молекулы должно произойти столкновение ионов, вероятность которого с разбавлением уменьшается.
4. Наличие одноименных ионов.
Добавление одноименных ионов уменьшает степень диссоциации, что также согласуется с принципом Ле Шателье. Например, в растворе слабой азотистой кислоты при электролитической диссоциации устанавливается равновесие между недиссоциированными молекулами и ионами:
НNО2 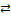 Н+ + NО2-.
Н+ + NО2-.
При введении в раствор азотистой кислоты нитрит-ионов NO2ˉ (прибавлением раствора нитрита калия КNО2) равновесие сместится влево, следовательно, степень диссоциации α уменьшится. Аналогичный эффект даст и введение в раствор ионов Н+.
Необходимо отметить, что не следует путать понятия «сильный электролит» и «хорошая растворимость». Например, растворимость СН3СООН в Н2О неограниченная, однако уксусная кислота относится к слабым электролитам (α = 0,014 в 0,1 М растворе). С другой стороны, ВаSО4 – малорастворимая соль (при 20°С растворимость меньше 1 мг в 100 г Н2О), но относится к сильным электролитам, так как все молекулы, перешедшие в раствор, распадаются на ионы Ва2+ и SО42-.
Константа диссоциации
Более точной характеристикой диссоциации электролита является константа диссоциации, которая от концентрации раствора не зависит.
Выражение для константы диссоциации можно получить, если записать уравнение реакции диссоциации электролита АК в общем виде:
AK  A– + K+.
A– + K+.
Поскольку диссоциация является обратимым равновесным процессом, то к этой реакцииприменим закон действующих масс, и можно определить константу равновесия как:

где К – константа диссоциации, которая зависит от температуры и природы электролита и растворителя, но не зависит от концентрации электролита.
Диапазон констант равновесия для разных реакций очень большой - от 10–16 до 1015.
Диссоциация веществ, состоящих более чем из двух ионов, происходит ступенчато. Для реакции вида
AnKm 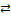 nA–m + mK+n
nA–m + mK+n
константа диссоциации имеет вид

Например, сернистая кислота диссоциирует ступенчато:
H2SO3 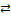 H+ + HSO3–
H+ + HSO3–
HSO3– 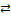 H+ + SO32–
H+ + SO32–
Каждая ступень диссоциации описывается своей константой:


При этом видно, что

При ступенчатой диссоциации веществ распад по последующей ступени всегда происходит в меньшей степени, чем по предыдущей. Иначе говоря:
Кд1> Кд2>…
Если концентрация электролита, распадающегося на два иона равна Св, а степень его диссоциации равна α, то концентрация образующихся ионов составит Свα, а концентрация недиссоциированных молекул – Св(1–α). Выражение для константы принимает следующий вид:

или

Это уравнение выражает закон разбавления Оствальда. Оно позволяет вычислять степень диссоциации при различных концентрациях электролита, если известна его константа диссоциации. Для слабых электролитов α<<1, тогда (1–α) → 1. Уравнение в этом случае принимает вид:

или

Это уравнение наглядно показывает, что степень диссоциации возрастает при разбавлении раствора.
В водных растворах сильные электролиты обычно полностью диссоциированы, поэтому число ионов в них больше, чем в растворах слабых электролитов той же концентрации. При этом силы межионного притяжения и отталкивания довольно велики. В таких растворах ионы не вполне свободны, движение их стеснено взаимным притяжением друг к другу. Благодаря этому притяжению каждый ион как бы окружен шарообразным роем противоположно заряженных ионов, получивших название «ионной атмосферы».
В отсутствии электрического поля ионная атмосфера симметрична и силы, действующие на центральный ион, взаимно уравновешиваются. Если же приложить к раствору постоянное электрическое поле, то разноименно заряженные ионы будут перемещаться в противоположных направлениях. При этом каждый ион стремится двигаться в одну сторону, а окружающая его ионная атмосфера – в противоположную, вследствие чего направленное перемещение иона замедляется, а следовательно, уменьшается число ионов, проходящих через раствор в единицу времени, т.е. сила тока. В связи с этим, определяемое по электрической проводимости значение степени диссоциации сильных электролитов называется кажущейся степенью диссоциации.
Все свойства раствора электролита, зависящие от концентрации ионов, проявляются так, если бы число ионов в растворе было меньше, чем это соответствует полной диссоциации электролита. Для оценки состояния ионов в растворе пользуются величиной, называемой активностью. Под активностью иона понимают ту эффективную, условную концентрацию его, соответственно которой он действует при химических реакциях.

где f, γ, y – рациональный, моляльный и молярный коэффициенты активности.
Коэффициенты активности различных ионов различны, кроме того они изменяются в зависимости от условий, в частности, при изменении концентрации раствора.
Кислоты, основания и соли
