Определение константы калориметра
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ИРКУТСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
ФИЗИЧЕСКАЯ ХИМИЯ
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Методические указания по выполнению лабораторных работ
Издательство
Иркутского государственного технического университета
Физическая химия. Химическая термодинамика. Методические указания по выполнению лабораторных работ . Составители П.Д.Белых, Е.В. Кудрявцева. - Иркутск: Изд-во ИрГТУ. - 2008. - 40 с.
Представлено описание лабораторных работ по основным разделам химической термодинамики: химическому равновесию, растворам, давлению насыщенного пара жидкостей и физико-химическому анализу. Изложены цели, порядок выполнения работы, а также её теоретическое обоснование.
Предназначены для студентов химико-металлургического факультета.
Библиогр. 7 назв. Ил. 13. Табл. 13
Рецензент: д-р хим. наук, профессор кафедры химии Волков А.Н.
| |
| ОГЛАВЛЕНИЕ | |
| ТЕРМОХИМИЯ …………………………….……………………………. Работа 1. Определение константы калориметра…………………... Работа 2. Определение молярной теплоты растворения………...... Работа 3. Определение удельной теплоты растворения неизвестной соли…………………………………………. Работа 4. Определение теплоты образования кристалло- гидрата…………………………………………………...... Работа 5. Определение теплоты нейтрализации…………………... Работа 6. Определение средней теплоемкости вещества…………. ХИМИЧЕСКОЕ РАВНОВЕСИЕ ………………………………………... Работа 1. Определение константы равновесия гомогенной химической реакции в растворе…………………………. Работа 2. Изучение зависимости константы равновесия гомогенной химической реакции от температуры........... РАСТВОРЫ ……………………………….……………………………… Работа 1. Определение молярной массы растворенного вещества криоскопическим методом…………………… Работа 2. Изучение равновесия жидкость – пар в двойной системе…………………………………………………..... ДАВЛЕНИЕ НАСЫЩЕННОГО ПАРА ЖИДКОСТЕЙ...…………….... Работа 1. Определение давления насыщенного пара индивидуальной жидкости……………………………… ФИЗИКО-ХИМИЧЕСКИЙ АНАЛИЗ………………………………........ Работа 1. Построение диаграммы плавкости двухкомпо- нентной системы нафталин – бензойная кислота визуально-политермическим методом………………… Работа 2. Построение диаграммы плавкости бинарной системы фенол – нафталин термографическим методом………………………………………………….. Работа 3. Определение критической температуры растворения в системе вода-фенол……………………………………………………….. Работа 4. Изучение взаимной растворимости трех жидкостей…... БИБЛИОГРАФИЧЕСКИЙ СПИСОК…………………………………… |
Перед выполнением работ студенты обязаны ознакомиться с их теоретическими основами. Отчет по лабораторной работе должен содержать теоретические основы работы, описание установки, экспериментальную и расчетную части и выводы. Все графики в отчете представляются на миллиметровой бумаге.
ТЕРМОХИМИЯ
Теоретическое введение
Термохимией называется раздел химической термодинамики, занимающийся изучением тепловых эффектов химических реакций и различных физико-химических процессов.
Основным законом термохимии является закон Гесса, вытекающий из первого начала термодинамики. Закон Гесса читается: тепловой эффект химической реакции не зависит от пути проведения реакции, а определяется родом веществ и начальным и конечным состоянием этих веществ.
Тепловой эффект равен количеству теплоты, которая выделяется или поглощается в результате протекания химической реакции или физико-химического процесса при соблюдении следующих условий:
¶ давление или объем постоянные (Р = const, V = const);
¶ температура постоянная (Т = const);
¶ совершается только работа расширения (PΔV).
Знание тепловых эффектов необходимо для составления тепловых балансов при разработке технологических процессов в химической, пищевой, металлургической и других отраслях промышленности. Если химическая реакция или процесс проводится при постоянном объеме, тепловой эффект равен изменению внутренней энергии системы ( 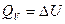 ). Многие технологические процессы протекают при постоянном давлении; в этом случае тепловой эффект равен изменению энтальпии системы (
). Многие технологические процессы протекают при постоянном давлении; в этом случае тепловой эффект равен изменению энтальпии системы ( 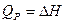 ).
).
Если теплота в результате реакции или процесса выделяется, то тепловой эффект имеет отрицательное значение (ΔU < 0, ΔН < 0). В случае поглощения теплоты знаки тепловых эффектов будут обратные.
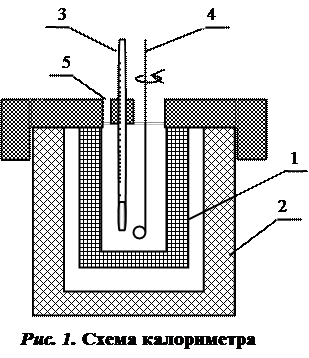
Тепловые эффекты определяют экспериментально калориметрическим методом. Для этого используют прибор, называемый калориметром. Простейший калориметр показан на рис. 1. Опыт проводится в сосуде Дьюара 1, помещенном в водяной термостат 2. В сосуде Дьюара находится термометр Бекмана 3 и мешалка 4. Навеска исследуемого вещества вводится в калориметр через отверстие 5 в крышке калориметра.
Для повышения точности измерения тепловых эффектов теплообмен между калориметром и окружающей средой должен быть сведен до минимума. После определения калориметрическим методом изменение температуры опыта рассчитывают тепловой эффект химической реакции или процесса по уравнению:
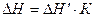 , (1)
, (1)
 где
где 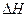 − тепловой эффект реакции или процесса;
− тепловой эффект реакции или процесса; 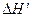 − количество теплоты, выделившейся или поглотившейся в калориметре при взаимодействии взятых молярных масс; К – коэффициент пересчета, равный отношению молярной массы вещества с учетом стехиометрического коэффициента в термохимическом уравнении реакции к массе этого вещества, взятой для проведения этого процесса.
− количество теплоты, выделившейся или поглотившейся в калориметре при взаимодействии взятых молярных масс; К – коэффициент пересчета, равный отношению молярной массы вещества с учетом стехиометрического коэффициента в термохимическом уравнении реакции к массе этого вещества, взятой для проведения этого процесса.
Величина 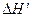 рассчитывается по уравнению теплового баланса:
рассчитывается по уравнению теплового баланса:
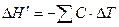 , (2)
, (2)
где 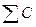 − суммарная теплоемкость исследуемой системы и калориметра; ΔТ – изменение температуры, вызванное исследуемым процессом.
− суммарная теплоемкость исследуемой системы и калориметра; ΔТ – изменение температуры, вызванное исследуемым процессом.
Суммарная теплоемкость может быть найдена по равенству:
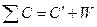 , (3)
, (3)
где 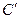 − теплоемкость исследуемой системы; W – константа калориметра.
− теплоемкость исследуемой системы; W – константа калориметра.
Теплоемкость исследуемой системы 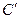 рассчитывается по справочным данным удельной или молярной теплоемкостей, взятым для опыта веществ с учетом их масс:
рассчитывается по справочным данным удельной или молярной теплоемкостей, взятым для опыта веществ с учетом их масс:
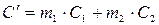 или
или 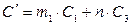 , (4)
, (4)
где m1 – масса растворителя, кг; С1 – удельная теплоемкость растворителя, Дж/(кг∙К); m2 – масса растворенного вещества, кг; С2 – удельная теплоемкость растворенного вещества, Дж/(кг∙К); n – число молей растворенного вещества, 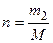 , моль;
, моль; 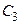 − молярная теплоемкость растворенного вещества, Дж/(моль∙К). Удельную теплоемкость можно рассчитать из следующего соотношения:
− молярная теплоемкость растворенного вещества, Дж/(моль∙К). Удельную теплоемкость можно рассчитать из следующего соотношения:
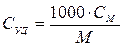 ,
,
где СУД и СМ – удельная и молярная теплоемкости; М – молярная масса растворенного вещества г/моль.
РАБОТА 1
ОПРЕДЕЛЕНИЕ КОНСТАНТЫ КАЛОРИМЕТРА
Цель работы: ознакомление с методикой определения константы калориметра по понижению температуры раствора при растворении хлоридов калия или аммония в воде.
