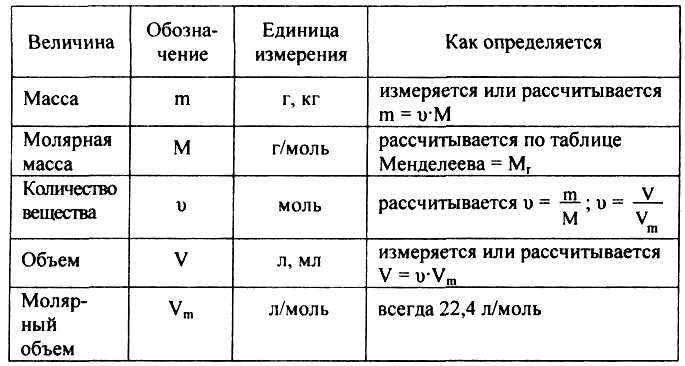
Относительная атомная масса
Атомно-молекулярное учение определяет атом, как мельчайшую химически неделимую частицу. А если это частица, то она должна иметь массу, которая очень мала. Современные методы исследования позволяют с большой точностью определять эту величину.
 Пример: m(H) = 1,674· 10-27кг
Пример: m(H) = 1,674· 10-27кг
m(O) = 2,667 · 10-26 кг Абсолютные массы
m (C) = 1,993 · 10-26 кг

Представленные величины очень неудобны для проведения вычислений. Поэтому в химии чаще используют не абсолютные, а относительные атомные массы. Относительная атомная масса (Аr) представляет собой отношение абсолютной массы атома к 1/12 массы атома углерода. С помощью формулы — это можно записать так 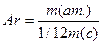
1/12m(c) является величиной сравнения и называется 1 а.е.м.
1а.е.м. = 1/12· 1,993 · 10-26 кг = 1,661 · 10-27 кг
Посчитаем Аr для некоторых элементов.
Аr(О) = 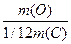 =
= 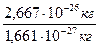 = 15,99 ~ 16
= 15,99 ~ 16
Аr(H) = 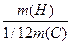 =
= 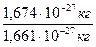 = 1,0079 ~ 1
= 1,0079 ~ 1
Сравнивая относительные атомные массы кислорода и водорода с абсолютными, хорошо видны преимущества Аr. Величины Аr намного проще. Их удобнее использовать в вычислениях. Готовые величины Аr приведены в таблице Менделеева. Используя Аr элементов, можно проводить сравнения их масс.
n= 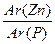 =
= 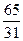 = 2,1
= 2,1
Данное вычисление показывает, что атом цинка весит в 2,1 раза больше, чем атом фосфора.
Относительная молекулярная масса (Mr) равна сумме относительных атомных масс, входящих в нее атомов (безразмерна). Вычислим относительную молекулярную массу воды. Вы знаете, что в состав молекулы воды входят два атома водорода и один атом кислорода. Тогда ее относительная молекулярная масса будет равна сумме произведений относительной атомной массы каждого химического элемента на число его атомов в молекуле воды:
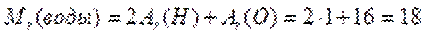
вычислите относительные молекулярные массы веществ.
Mr (Cu2O)=143,0914
Mr (Na3PO4)= 163,9407
Mr (AlCl3)= 133,3405
Mr (Ba3N2)= 439,9944
Mr (KNO3)= 101,1032
Mr (Fe (OH)2)= 89,8597
Mr (Mg(NO3)2)= 148,3148
Mr (Al2(SO4)3)= 342,1509
Количество вещества (n) — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе.Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы).
Единицей измерения количества вещества (n) является моль. Моль – количество вещества, содержащее столько структурных элементарных единиц (молекул, атомов, ионов, электронов и т.д.), сколько содержится атомов в 0,012 кг (12 г) = 1 моль изотопа углерода 12С.

Число атомов NA в 0,012 кг (12 г) углерода, или в 1 моль, легко определить следующим образом:
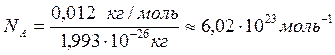 .
.
Величина NA называется постоянной Авогадро.
При описании химических реакций, количество вещества является более удобной величиной, чем масса, так как молекулы взаимодействуют независимо от их массы в количествах, кратных целым числам.
Например, для реакции горения водорода (2H2 + O2 → 2H2O) требуется в два раза большее количество вещества водорода, чем кислорода. Соотношение между количествами реагирующих веществ непосредственно отражается коэффициентами в уравнениях.
Пример: в 1 моле хлорида кальция = содержит 6,022×1023 молекул (формульных единиц) - CaCl2.
1 моль (1 М) железа = 6.1023 атомов Fe
1 моль (1 М) ионов хлора Cl- = 6.1023 ионов Cl-.
1 моль (1 М) электронов е- = 6.1023 электронов е-.
Для вычисления количества вещества на основании его массы пользуются понятием молярная масса:
Молярная масса (М) - это масса одного моля вещества (кг/моль, г/моль). Относительная молекулярная масса и молярная масса вещества численно совпадают, но имеют разную размерность, например, для воды Мr = 18 (относительная атомная и молекулярная массы величины безразмерные), М = 18 г/моль. Количество вещества и молярная масса связаны простым соотношением:

Большую роль в формировании химической атомистики сыграли основные стехиометрические законы, которые были сформулированы на рубеже XVII и XVIII столетий.
1. ЗАКОН СОХРАНЕНИЯ МАССЫ (М.В. Ломоносов,1748).
Сумма масс продуктов реакции равна сумме масс исходных веществ. В качестве дополнения к этому закону может служить закон сохранения массы элемента (1789, А.Л. Лавуазье) - масса химического элемента в результате реакции не изменяется. Эти законы имеют для современной химии определяющее значение, поскольку позволяют моделировать химические реакции уравнениями и выполнять на их основе количественные вычисления.
2. ЗАКОН ПОСТОЯНСТВА СОСТАВА (Ж. Пруст,1799-1804).
Индивидуальное химическое вещество молекулярного строения имеет постоянный качественный и количественный состав, не зависящий от способа его получения. Соединения, подчиняющиеся закону постоянства состава, называют дальтонидами. Дальтонидами являются все известные к настоящему времени органические соединения (около 30 миллионов) и часть (около 100 тыс.) неорганических веществ. Вещества, имеющие немолекулярное строение (бертолиды), не подчиняются данному закону и могут иметь переменный состав, зависящий от способа получения образца. К ним относятся большинство (около 500 тыс.) неорганических веществ.
3. ЗАКОН ЭКВИВАЛЕНТОВ (И. Рихтер, Дж. Дальтон, 1792-1804).
Каждое сложное вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав. Следовательно, химические вещества взаимодействуют друг с другом в строго определенных (эквивалентных) соотношениях. Массы реагирующих веществ прямо пропорциональны их эквивалентным массам.
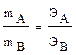 ,
,
где ЭА и ЭВ - эквивалентные массы реагирующих веществ.
4. ЗАКОН АВОГАДРО(А. Авогадро,1811).
В равных объемах разных газов, измеренных в одинаковых условиях (давление, температура), содержится одинаковое число молекул. Из закона следует, что:
Ø При нормальных условиях (н.у., Т = 273 К, р = 101,325 кПа) один моль любого газа занимает одинаковый объем - молярный объем (Vm), равный 22,4 л/моль.
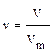
Ø Отношение масс равных объемов разных газов, измеренных в одинаковых условиях (относительная плотность газа по газу), равна отношению их молекулярных (молярных) масс.

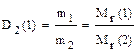
Чаще всего определяют относительную плотность по водороду или воздуху. Соответственно,
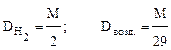 ,
,
где 29 - средняя, точнее средневзвешенная, молекулярная масса воздуха.
Ø Объемы реагирующих газов относятся друг к другу и к объемам газообразных продуктов реакции как простые целые числа (закон объемных отношений Гей-Люссака).
Задача
Сколько граммов газообразного хлора нужно потратить и сколько граммов жидкого хлорида фосфора(III) получиться если в реакции использовано 1,45 граммов фосфора?
Р4 (тв.) + Cl2 (г.) = PCl3 (ж.)
Решение: 1. Необходимо убедиться, что уравнение находиться в равновесии, т.е. необходимо проставить стехиометрические коэффициенты: Р4 (тв.) + 6Cl2 (г.) = 4PCl3 (ж.). На 1 моль Р4 я могу потратить 6 моль Cl2, чтобы получить 4 моля PCl3
2. У нас есть масса Р4 в реакции, следовательно, можно узнать сколько молей фосфора использовано. По Т.М. узнаем атомную массу фосфора ~ 31, это говорит, что 1 моль фосфора будет иметь массу 31 г (молярная масса), а атомная масса Р4 будет 124 г. Найдем сколько молей в 1,45 г фосфора:
1,45 г – х моль х=0,0117 моль
124 г – 1 моль
3. Теперь узнаем сколько молей хлора нужно взять для использования 0,0117 молей фосфора. По равновесной реакции мы видим, что на 1 моль фосфора нужно взять 6 молей хлора, следовательно, хлора нужно взять в 6 раз больше. Считаем:
0,0117 х 6 = 0,07 молей хлора.
4. Теперь можем посчитать сколько граммов хлора нужно потратить:
0,07 молей х 70,906 г (в 1 моле Cl2) = 4,963 г Cl2
5. Теперь найдем сколько граммов жидкого хлорида фосфора(III) получиться. Можно воспользоваться двумя разными решениями:
5.1. Закон сохранения массы 1,45г Р4 (тв.) + 4,963 г. Cl2 (г.) = 6,413 г.PCl3 (ж.)
5.2. А можно воспользоваться способом как мы находили массу необходимого фосфора.

Примеры:
Условие
Определите массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2 • 2H2O
Решение
Молярная масса BaCl2 • 2H2O составляет:
М(BaCl2 • 2H2O) = 137+ 2 • 35,5 + 2 • 18 =244 г/моль
Из формулы BaCl2 • 2H2O следует, что 1 моль дигидрата хлорида бария содержит 2 моль Н2О.
Определяем массу воды, содержащейся в BaCl2 • 2H2O: m(H2O) = 2 • 18 = 36 г.
Находим массовую долю кристаллизационной воды в дигидрате хлорида бария
BaCl2 • 2H2O. ω(H2O) = m(H2O)/ m(BaCl2 • 2H2O) = 36/244 = 0,1475 = 14,75%.

Пример самостоятельно
1.Химическое соединение содержит по массе 17,56% натрия, 39,69% хрома и 42,75% кислорода. Определите простейшую формулу соединения. (Na2Cr2O7).
2. Элементный состав вещества следующий: массовая доля элемента железа 0,7241 (или 72,41%), массовая доля кислорода 0,2759 (или 27,59%). Выведите химическую формулу. (Fe3O4)
Пример (разбор). Установите молекулярную формулу вещества, если массовая доля углерода в нем составляет 26,67%, водорода – 2,22%, кислорода – 71,11%. Относительная молекулярная масса этого вещества равна 90.
Решение 1. Для решения задачи используем формулы: w = 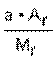 ; n = ; n = 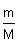 ; x : y : z = n(C) : n(H) : n(O). 2. Находим химические количества элементов, входящих в состав вещества, приняв, что m(CxHyOz) = 100 г. m(C) = w(C) · m(CxHyOz) = 0,2667 · 100 г = 26,67 г. m(H) = w(H) · m(CxHyOz) = 0,0222 · 100 г = 2,22 г. m(O) = w(O) · m(CxHyOz) = 0,7111 · 100 г = 71,11 г. n(C) = ; x : y : z = n(C) : n(H) : n(O). 2. Находим химические количества элементов, входящих в состав вещества, приняв, что m(CxHyOz) = 100 г. m(C) = w(C) · m(CxHyOz) = 0,2667 · 100 г = 26,67 г. m(H) = w(H) · m(CxHyOz) = 0,0222 · 100 г = 2,22 г. m(O) = w(O) · m(CxHyOz) = 0,7111 · 100 г = 71,11 г. n(C) = 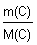 = = 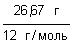 = 2,22 моль.; n(H) = = 2,22 моль.; n(H) = 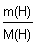 = = 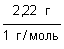 = 2,22 моль.; n(O) = = 2,22 моль.; n(O) = 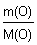 = = 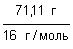 = 4,44 моль. 3. Определяем эмпирическую формулу вещества: n(C) : n(H) : n(O) = 2,22 моль : 2,22 моль : 4,44 моль. x : y : z = 1 : 1 : 2. Эмпирическая формула вещества – CHO2. 4. Устанавливаем истинную молекулярную формулу вещества: Mr(CHO2) = Ar(C) + Ar(H) + 2Ar(O) = 12 + 1 + 2·16 = 45; Mr(CHO2) : Mr(CxHyOz) = 45 : 90 = 1 : 2. Истинная молекулярная формула вещества – C2H2O4. Ответ: молекулярная формула вещества C2H2O4. Задача.Найдите химическую формулу вещества, в состав которого входит 9 мас. ч. алюминия и 8 мас. ч. кислорода. Решение: Находим отношение числа атомов: = 4,44 моль. 3. Определяем эмпирическую формулу вещества: n(C) : n(H) : n(O) = 2,22 моль : 2,22 моль : 4,44 моль. x : y : z = 1 : 1 : 2. Эмпирическая формула вещества – CHO2. 4. Устанавливаем истинную молекулярную формулу вещества: Mr(CHO2) = Ar(C) + Ar(H) + 2Ar(O) = 12 + 1 + 2·16 = 45; Mr(CHO2) : Mr(CxHyOz) = 45 : 90 = 1 : 2. Истинная молекулярная формула вещества – C2H2O4. Ответ: молекулярная формула вещества C2H2O4. Задача.Найдите химическую формулу вещества, в состав которого входит 9 мас. ч. алюминия и 8 мас. ч. кислорода. Решение: Находим отношение числа атомов: 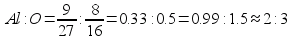 Ответ: Химическая формула данного вещества: Ответ: Химическая формула данного вещества: 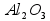 . Относительная плотность газа Х по газу У — DпоУ(Х). Часто в задачах просят определить формулу вещества (газа) в зависимости от Относительной плотности D — это величина, которая показывает, во сколько раз газ Х тяжелее газа У. Её рассчитывают как отношение молярных масс газов Х и У: DпоУ(Х) = М(Х) / М(У) Часто для расчетов используют относительные плотности газов по водороду и по воздуху. Относительная плотность газа Х по водороду: Dпо H2 = M(газа Х) / M(H2) = M(газа Х) / 2 Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за 29 г/моль (исходя из примерного усреднённого состава). Поэтому: Dпо возд. = М(газа Х) / 29 Пример: Определить формулу вещества, если оно содержит 84,21% С и 15,79% Н и имеет относительную плотность по воздуху, равную 3,93. Пусть масса вещества равна 100 г. Тогда масса С будет равна 84,21 г, а масса Н — 15,79 г. 1. Найдём количество вещества каждого атома: ν(C) = m / M = 84,21 / 12 = 7,0175 моль, ν(H) = 15,79 / 1 = 15,79 моль. 2.Определяем мольное соотношение атомов С и Н: С : Н = 7,0175 : 15,79 (поделим оба числа на меньшее) = 1 : 2,25 (будем домножать на 1, 2,3,4 и т.п. пока после запятой не появится 0 или 9. В данной задаче нужно домножить на 4) = 4 : 9. Таким образом, простейшая формула — С4Н9. 3. По относительной плотности рассчитаем молярную массу: М = D(возд.) • 29 = 114 г/моль. Молярная масса, соответствующая простейшей формуле С4Н9 — 57 г/моль, это в 2 раза меньше истинно молярной массы. Значит, истинная формула — С8Н18. . Относительная плотность газа Х по газу У — DпоУ(Х). Часто в задачах просят определить формулу вещества (газа) в зависимости от Относительной плотности D — это величина, которая показывает, во сколько раз газ Х тяжелее газа У. Её рассчитывают как отношение молярных масс газов Х и У: DпоУ(Х) = М(Х) / М(У) Часто для расчетов используют относительные плотности газов по водороду и по воздуху. Относительная плотность газа Х по водороду: Dпо H2 = M(газа Х) / M(H2) = M(газа Х) / 2 Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за 29 г/моль (исходя из примерного усреднённого состава). Поэтому: Dпо возд. = М(газа Х) / 29 Пример: Определить формулу вещества, если оно содержит 84,21% С и 15,79% Н и имеет относительную плотность по воздуху, равную 3,93. Пусть масса вещества равна 100 г. Тогда масса С будет равна 84,21 г, а масса Н — 15,79 г. 1. Найдём количество вещества каждого атома: ν(C) = m / M = 84,21 / 12 = 7,0175 моль, ν(H) = 15,79 / 1 = 15,79 моль. 2.Определяем мольное соотношение атомов С и Н: С : Н = 7,0175 : 15,79 (поделим оба числа на меньшее) = 1 : 2,25 (будем домножать на 1, 2,3,4 и т.п. пока после запятой не появится 0 или 9. В данной задаче нужно домножить на 4) = 4 : 9. Таким образом, простейшая формула — С4Н9. 3. По относительной плотности рассчитаем молярную массу: М = D(возд.) • 29 = 114 г/моль. Молярная масса, соответствующая простейшей формуле С4Н9 — 57 г/моль, это в 2 раза меньше истинно молярной массы. Значит, истинная формула — С8Н18. | |
